北京市大兴区2023-2024学年高三上学期期末考试化学试题
试卷更新日期:2024-03-21 类型:期末考试
一、本部分每小题只有一个选项符合题意,每小题3分
-
1. 2022年2月,北京冬奥会秉承了创新、协调、绿色、开放、共享发展的理念。下列冬奥会使用的物品中,主要材料不属于有机高分子材料的是( )
A
B
C
D




冰墩墩中的聚酯纤维
速滑馆中的铝制幕墙
雪花花瓣中的聚碳酸酯
头盔表面的聚氨酯涂料
A、A B、B C、C D、D2. 下列溶液中,酸碱性与其他三种不一致的是( )A、H2S溶液 B、NaHCO3溶液 C、K2S溶液 D、氨水3. 下列有关化学用语或图示表达正确的是( )A、二氧化硫的VSEPR模型: B、CO2的电子式:
B、CO2的电子式: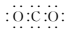 C、中子数为8的碳原子:814C
D、基态氧原子的轨道表示式:
C、中子数为8的碳原子:814C
D、基态氧原子的轨道表示式: 4. 用NA表示阿伏加德罗常数的值。下列说法正确的是( )A、常温下,0.1 mol NH3的体积为2.24 L B、1 mol HCCH分子中含有σ键的数目为 2 NA C、1 L 0.1 mol·L-1 Na2CO3溶液中CO32- 数目小于0.1 NA D、25℃时, pH=5的NH4Cl溶液中由水电离出的H+的浓度为10-9 mol·L-15. 短周期元素G、M、W、X、Y、Z、Q的原子半径及其最高正化合价随原子序数递增的变化如图所示:
4. 用NA表示阿伏加德罗常数的值。下列说法正确的是( )A、常温下,0.1 mol NH3的体积为2.24 L B、1 mol HCCH分子中含有σ键的数目为 2 NA C、1 L 0.1 mol·L-1 Na2CO3溶液中CO32- 数目小于0.1 NA D、25℃时, pH=5的NH4Cl溶液中由水电离出的H+的浓度为10-9 mol·L-15. 短周期元素G、M、W、X、Y、Z、Q的原子半径及其最高正化合价随原子序数递增的变化如图所示:
下列说法正确的是( )
A、熔点:M < Y B、第一电离能:X > W > G C、热稳定性: HQ > H2Z > HW D、酸性:HQO4 > H2ZO4 > H2YO36. 常温下,NH4Cl溶于水得到无色溶液,为使溶液中的c(NH4+) : c(Cl-) = 1:1,下列采取的措施正确的是( )A、加入适量的NaCl固体 B、加入适量的盐酸,抑制NH4+水解 C、加入适量的氨水,使溶液的pH等于7 D、加入适量的NaOH固体,使溶液的pH等于77. 下列实验事实所对应的离子方程式不正确的是( )A、CO2溶于水产生HCO3-: CO2 + H2O H2CO3 HCO3- + H+ B、FeCl3溶液呈酸性: Fe3+ + 3H2O = Fe(OH)3↓ + 3H+ C、NO2溶于H2O红棕色消失: 3NO2 + H2O =2H+ + 2NO3- + NO D、向海带灰浸出液(含I-)中滴加几滴酸化的过氧化氢溶液:2I- + H2O2 + 2H+ =I2 + 2H2O8. 用下列仪器或装置(夹持装置略)进行实验,不能达到实验目的的是( )A
B
C
D




实验室制取氨气
分离碳酸钠溶液和乙酸乙酯
制备无水氯化镁
证明醋酸为弱酸
A、A B、B C、C D、D9. 离子液体具有较好的化学稳定性、较低的熔点及对无机物、有机化合物等不同物质良好溶解性等优点。一种离子液体的结构简式如下图。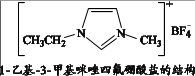
下列说法不正确的是( )
A、该离子液体能与H2O形成氢键 B、阳离子中C原子有sp2、sp3两种杂化方式 C、阴离子呈平面正方形,存在共价键和配位键 D、该离子液体熔点较低的可能原因是离子体积增大、距离增大、作用力减弱10. 某小组同学在实验室利用下图装置制备水处理剂高铁酸钾(K2FeO4),反应的化学方程式为:2FeCl3 + 3Cl2 + 16KOH 2K2FeO4 + 12KCl + 8H2O。
已知:参与原电池反应的氧化剂(还原剂)氧化性(还原性)越强,原电池的电压越大。
下列说法不正确的是( )
A、右侧的电极反应式为:Fe3+-3e- + 8OH- = FeO42- + 4H2O B、再向右侧烧杯中加入KOH固体,电压表示数会变大 C、盐桥中的阴离子向左侧烧杯中移动 D、其他条件相同时,选用Fe(NO3)3代替FeCl3 , 也可以制备K2FeO411. 某种用于隐形眼镜的材料由两种单体合成,其片段如下: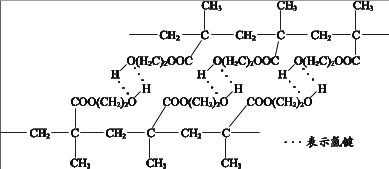
下列关于该高分子说法不正确的是( )
A、结构简式可以表示为: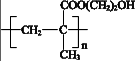 B、氢键对该高分子的性能会产生影响
C、合成该高分子的一种单体是CH2 = C(CH3)COOH
D、两种单体都能与金属Na和NaHCO3反应
12. 某同学在培养皿上做如下实验(如图所示),a、b、c、d是浸有相关溶液的滤纸。向KMnO4晶体上滴加一滴浓盐酸后,立即用另一培养皿扣在上面。
B、氢键对该高分子的性能会产生影响
C、合成该高分子的一种单体是CH2 = C(CH3)COOH
D、两种单体都能与金属Na和NaHCO3反应
12. 某同学在培养皿上做如下实验(如图所示),a、b、c、d是浸有相关溶液的滤纸。向KMnO4晶体上滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4 + 16HCl = 2KCl + 5Cl2↑ + 2MnCl2 + 8H2O
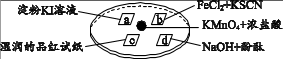
下列对“实验现象”的“解释或结论”描述,不正确的是( )
选项
实验现象
解释或结论
A
a处试纸变蓝
氧化性:Cl2 > I2
B
b处试纸变红
Cl2 + 2Fe2+ = 2Cl- + 2Fe3+
C
c处试纸褪色
Cl2与H2O反应生成了具有漂白性的物质
D
d处红色褪去
Cl2 和NaOH反应使溶液呈中性
A、A B、B C、C D、D13. 实验测得0.5 mol·L-1 CH3COONa溶液及纯水的pH随温度变化的曲线如图所示。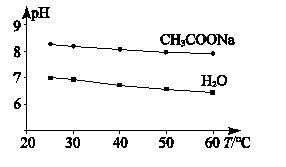
下列说法不正确的是( )
A、CH3COONa溶液中c(Na+) > c(CH3COO-) B、随温度升高纯水中c(H+) > c(OH-) C、升温促进了水的电离和醋酸钠水解 D、升温使CH3COONa溶液中c(H+)/c(OH-)比值减小14. 小组同学模拟工业上常采用电解法处理含铬(VI)盐废水。不同反应条件时,对Cr2O72-处理的结果如表1所示(Cr2O72-的起始浓度、体积、电压、电解时间均相同);其中,实验③中Fe3+在去除Cr2O72-过程中的作用机理如图1所示。已知:Cr2O72-(橙) + H2O 2 CrO42-(黄) + 2 H+
下列对实验过程的分析中,不正确的是( )
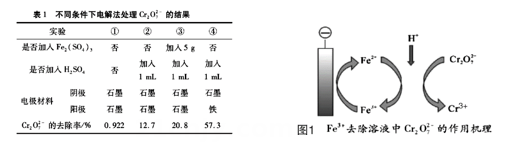 A、实验①~④中,实验④的Cr2O72-去除效果最好 B、实验②~④中,加入H2SO4可以提高溶液中Cr2O72-的浓度和氧化性 C、分析图1, Cr2O72-参与的反应为:6 Fe2++ 14 H+ + Cr2O72- = 6 Fe3+ + 2Cr3++ 7H2O D、实验④中,阳极上Fe发生的反应为:Fe – 3e- = Fe3+
A、实验①~④中,实验④的Cr2O72-去除效果最好 B、实验②~④中,加入H2SO4可以提高溶液中Cr2O72-的浓度和氧化性 C、分析图1, Cr2O72-参与的反应为:6 Fe2++ 14 H+ + Cr2O72- = 6 Fe3+ + 2Cr3++ 7H2O D、实验④中,阳极上Fe发生的反应为:Fe – 3e- = Fe3+二、非选择题(共58分)
-
15. 过渡金属钛(Ti)性能优越,是继铁、铝之后应用广泛的“第三金属”。
回答下列问题。
(1)、钛元素位于周期表的区; 基态Ti原子核外电子占据的轨道数为。(2)、下列状态的Ti原子中,失去最外层一个电子所需能量最大的是 (填字母标号)。a.[Ar]3d²4s¹4p¹ b.[Ar]3d²4s²
c.[Ar]3d14s²4p¹ d.[Ar]3d¹4s¹4p²
(3)、TiCl4是氧化法制取钛的中间产物,TiCl4分子结构与CCl4相同,二者常温下都是无色液体。TiCl4分子的空间结构为 , TiCl4极易水解且水解程度很大,生成TiO2·xH2O沉淀,写出TiCl4水解的化学方程式:。(4)、钛的某配合物可用于催化环烯烃聚合,其结构如下图所示。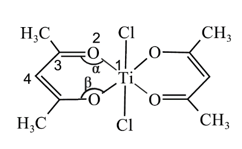
下列说法正确的是(填字母)。
a.含有手性碳原子
b.2号氧提供孤电子对与钛离子形成配位键
c.1-4号原子不在同一平面上
d.∠α大于∠B
(5)、嫦娥三号卫星上的PIC元件(热敏电阻)的主要成分——钡钛 矿的晶胞结构如图所示。已知该晶体的密度为ρg·cm-3 , 阿伏加 德罗常数的值为NA , 则该晶胞的边长为cm (用含ρ、的 式子表示)。(注:相对原子质量 Ba-137 Ti-48 O-16) 16. 的资源化利用是实现“碳中和、碳达峰”的途径。合成甲醇的过程中涉及如下反应:
16. 的资源化利用是实现“碳中和、碳达峰”的途径。合成甲醇的过程中涉及如下反应:反应i.CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H1
反应ii.CO2(g) + H2(g) CO(g) + H2O(g) △H2= + 41.2 kJ·mol-1
回答下列问题。
(1)、根据下图,△H1 =kJ·mol-1。 (2)、T℃时,向1 L恒容、密闭容器中充入1 mol CO2和4 mol H2发生上述反应。10 min末已达到平衡时测得容器中CO2的转化率为90%,CO的物质的量为0.3 mol。
(2)、T℃时,向1 L恒容、密闭容器中充入1 mol CO2和4 mol H2发生上述反应。10 min末已达到平衡时测得容器中CO2的转化率为90%,CO的物质的量为0.3 mol。① 0~10 min内,平均反应速率v (CH3OH) =mol·L-1·min-1。
② T℃时,反应ii的化学平衡常数K =。
(3)、将原料气n(CO2):n(H2)=1:3充入某一恒容、密闭容器中,若只发生反应i,在不同催化剂作用下,反应t min时CO2的转化率随温度的变化如下图所示。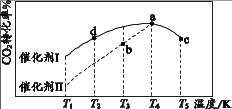
①图中达到化学平衡状态的是(填“a”“b”“c” “d”)。
② 其他条件相同,若将原料气按n (CO2):n(H2)=1:2.8充入同一恒容、密闭容器中,在催化剂I的作用下发生反应。该条件下,a点时CO2的转化率(填“增大”或“不变”或“减小”)。
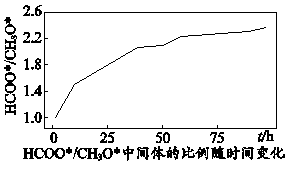 (4)、近日,我国学者研究发现,在单原子催化时,反应i的历程以及中间体
(4)、近日,我国学者研究发现,在单原子催化时,反应i的历程以及中间体与物质的量之比随时间变化图如下:
第一步
第二步
第三步
下列说法正确的是。
A.其他条件相同时,升高温度时,三步反应速率均加快
B.用不同催化剂催化反应可以改变反应历程,提高平衡转化率
C.反应历程中,第二步反应的活化能最高,是反应的决速步骤
(5)、光催化CO2制甲醇技术也是研究热点。铜基纳米光催化材料 还原CO2的机理如图所示。写出CO2转化为CH3OH的电极反应式为。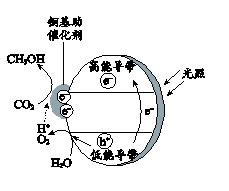 17. 化合物G是用于治疗慢性便秘药品普卡必利的中间体,其合成路线如下:
17. 化合物G是用于治疗慢性便秘药品普卡必利的中间体,其合成路线如下:
已知:

回答下列问题。
(1)、有机物A中的官能团为羟基、羧基和。(2)、反应A→B的化学方程式为。(3)、M + C→D为可逆反应,推测K2CO3的作用:。(4)、E的结构简式为。(5)、写出符合下列条件的B的一种同分异构体的结构简式。① 属于α-氨基酸(氨基连接在与羧基相连的碳原子上)
② 遇FeCl3溶液显紫色
(6)、请根据流程中的信息,设计以苯酚和CH2 = CH-CH2Br为原料合成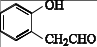 的合成路线。 18. 五水合硫代硫酸钠(Na2S2O3 • 5H2O)俗称“海波”,常用作棉织物漂白后的脱氧剂、定量分析中的还原剂。
的合成路线。 18. 五水合硫代硫酸钠(Na2S2O3 • 5H2O)俗称“海波”,常用作棉织物漂白后的脱氧剂、定量分析中的还原剂。资料:① Na2S2O3 • 5H2O无色、易溶于水,难溶于乙醇;
② Na2S2O3在酸性溶液中反应有S和SO2产生
(一)制备
工业上可用SO2、Na2S和 Na2CO3制备Na2S2O3 • 5H2O,其工艺流程示意图如下:
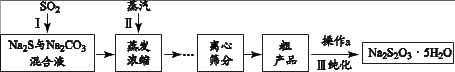 (1)、实验室可用浓硫酸与Cu反应制备SO2气体,该反应的化学方程式是。(2)、 ① 配平I中反应的化学方程式: Na2S + SO2 + Na2CO3 = Na2S2O3 + CO2
(1)、实验室可用浓硫酸与Cu反应制备SO2气体,该反应的化学方程式是。(2)、 ① 配平I中反应的化学方程式: Na2S + SO2 + Na2CO3 = Na2S2O3 + CO2② 当I中溶液的pH约为7时应停止通入SO2 , 否则Na2S2O3的产率下降,结合离子方程式说明其原因。
(3)、II.粗产品提纯已知粗产品中可能会含有少量Na2SO3和Na2SO4 , Na2S2O3在水中的溶解度随温度的升高而显著增大。
① 检验粗产品中含有Na2SO4的方法是:取少量固体溶解, 先加足量的溶液,静置、过滤, , 有白色沉淀生成。
② 粗产品的提纯过程III中,操作a的步骤为:加热溶解、趁热过滤、、过滤、(填洗涤试剂名称)洗涤、干燥。
(4)、III.纯度测定准确称取a g产品于锥形瓶中,加入一定量蒸馏水完全溶解后,加入适量甲醛溶液预处理(防止Na2SO3与I2反应),以淀粉作指示剂,用c mol/L I2的标准溶液滴定,发生如下反应:I2 + 2S2O32- = 2I-+ , 三次平行实验,平均消耗v mL I2溶液。
(已知:Na2S2O3 • 5H2O的摩尔质量为248 g/mol )
① 产品中Na2S2O3•5H2O的纯度为 (写出质量分数的表达式即可)。
② 下列操作可能造成实验结果偏高的是。
A.滴定管未用I2标准溶液润洗
B.滴定终点时仰视读数
C.滴定过程中锥形瓶内有少量液体溅出瓶外
19. 某小组同学将过量的AgNO3 溶液滴加到饱和氯水中,发现氯水的漂白性出现异常,于是对相关的反应进行了探究。(1)、I.发现问题
①氯气与水反应的化学方程式为。小组同学猜测加入AgNO3溶液后,生成沉淀,使c(Cl-)降低,c(HClO)增大,氯水漂白性增强,于是进行如下实验。
②与过量AgNO3溶液反应后,氯水漂白性减弱的实验证据是。
Ⅱ.查阅资料:AgClO为白色晶体,常温下难溶于水
提出猜想:反应中除生成AgCl外,还有AgClO生成
III.实验探究

已知:AgI + I- AgI2-
编号
实验操作
实验现象
i
向a1试管中加入2 mL浓盐酸,并用湿润的淀粉KI试纸靠近试管口
产生刺激气味的气体,试纸变蓝
ii
向a2试管中加入2 mL饱和KI溶液,振荡,再滴入2滴淀粉溶液
加入饱和KI溶液,白色沉淀变为黄色,振荡后沉淀溶解,滴加淀粉溶液,溶液变蓝。
iii
向另一支试管a3中只加入2 mL饱和KI溶液,振荡,再滴入2滴淀粉溶液,与实验ii放置相同时间
滴入淀粉溶液,无明显变化
(2)、操作a的名称是。(3)、实验i中产生刺激气味的气体,可能的反应方程式是。(4)、实验ii表明,固体b中含有AgClO,且AgClO的溶解度大于AgI,请结合实验现象进行解释。(5)、实验iii的作用是。(6)、综上,过量的AgNO3 溶液滴加到饱和氯水后,氯水漂白性减弱的可能原因是。