江苏省泰州市联盟五校2023-2024学年高二上学期期中考试化学试卷
试卷更新日期:2024-03-01 类型:期中考试
一、单项选择题(共13题,每题3分,共39分。每题只有一个选项最符合题意。)
-
1. 下列说法正确的是( )A、图为质谱图
 B、
B、 的命名:2-甲基丁烷
C、乙烯的结构简式为CH2CH2
D、NH3的VSEPR模型为
的命名:2-甲基丁烷
C、乙烯的结构简式为CH2CH2
D、NH3的VSEPR模型为 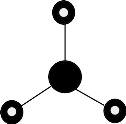 2. 下列变化中,由加成反应引起的是( )A、乙醇滴入酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色 B、甲烷与氯气混合后,在光照条件下,黄绿色逐渐消失 C、在催化剂存在下,苯与液溴反应生成溴苯 D、乙炔通入溴的四氯化碳溶液中,溴的四氯化碳溶液褪色3. 在给定条件下,下列选项中所示物质间的转化均能实现的是( )A、
2. 下列变化中,由加成反应引起的是( )A、乙醇滴入酸性高锰酸钾溶液中,酸性高锰酸钾溶液褪色 B、甲烷与氯气混合后,在光照条件下,黄绿色逐渐消失 C、在催化剂存在下,苯与液溴反应生成溴苯 D、乙炔通入溴的四氯化碳溶液中,溴的四氯化碳溶液褪色3. 在给定条件下,下列选项中所示物质间的转化均能实现的是( )A、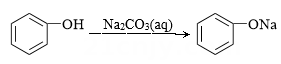 B、
B、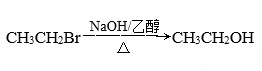 C、
C、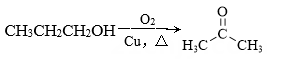 D、
D、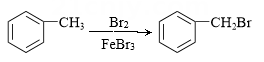 4. 下列有关实验装置进行的相应实验,能达到实验目的的是( )
4. 下列有关实验装置进行的相应实验,能达到实验目的的是( )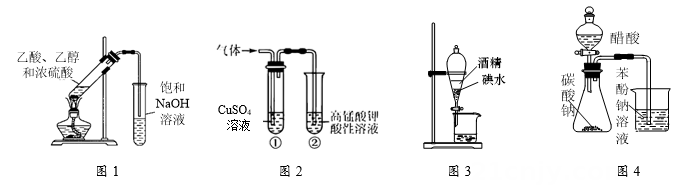 A、用图1装置制备乙酸乙酯 B、用图2检验电石与水反应产生的乙炔 C、用图3装置用酒精萃取碘水中的碘 D、用图4验证酸性:醋酸>碳酸>苯酚5. X、Y、Z、M、N属于周期表短周期主族元素,且原子序数依次增大。元素X的基态原子中所含3个能级的电子数均相等,元素Z的基态原子中2p能级上成单电子数与X相同,M与X同主族,元素N的基态原子只含有1个未成对电子。下列说法正确的是( )A、原子半径:r(X)<r(M)<r(N) B、XZ2和MZ2的晶体类型相同 C、第一电离能:I1(X)<I1(Z)<I1(Y) D、最高价氧化物对应水化物的酸性:N<M6. 已知O2在一定条件下能有效去除烟气中的SO2、NO,可能的反应机理如题3图所示,下列说法正确的是( )
A、用图1装置制备乙酸乙酯 B、用图2检验电石与水反应产生的乙炔 C、用图3装置用酒精萃取碘水中的碘 D、用图4验证酸性:醋酸>碳酸>苯酚5. X、Y、Z、M、N属于周期表短周期主族元素,且原子序数依次增大。元素X的基态原子中所含3个能级的电子数均相等,元素Z的基态原子中2p能级上成单电子数与X相同,M与X同主族,元素N的基态原子只含有1个未成对电子。下列说法正确的是( )A、原子半径:r(X)<r(M)<r(N) B、XZ2和MZ2的晶体类型相同 C、第一电离能:I1(X)<I1(Z)<I1(Y) D、最高价氧化物对应水化物的酸性:N<M6. 已知O2在一定条件下能有效去除烟气中的SO2、NO,可能的反应机理如题3图所示,下列说法正确的是( ) A、SO2的键角小于120° B、和H2O中心原子的杂化方式相同 C、N的价电子轨道排布式为
A、SO2的键角小于120° B、和H2O中心原子的杂化方式相同 C、N的价电子轨道排布式为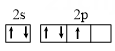 D、参与了反应,其电子式为
D、参与了反应,其电子式为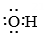 7. 阅读下列材料,回答问题:阿司匹林是一种合成药物,化学名称为乙酰水杨酸,具有解热镇痛作用。人体血液的pH范围为7.35~7.45,长期大量服用阿司匹林会引发酸中毒,可静脉滴注NaHCO3溶液进行缓解。阿司匹林的发现源于柳树皮中含有的一种物质——水杨酸,阿司匹林以水杨酸为原料进行生产,反应如下:
7. 阅读下列材料,回答问题:阿司匹林是一种合成药物,化学名称为乙酰水杨酸,具有解热镇痛作用。人体血液的pH范围为7.35~7.45,长期大量服用阿司匹林会引发酸中毒,可静脉滴注NaHCO3溶液进行缓解。阿司匹林的发现源于柳树皮中含有的一种物质——水杨酸,阿司匹林以水杨酸为原料进行生产,反应如下: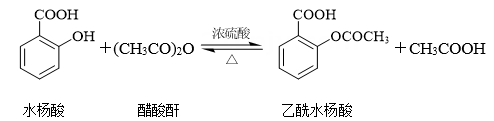
用乙二醇将乙酰水杨酸与聚甲基丙烯酸(
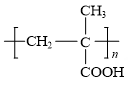 )连接起来,可得到缓释阿司匹林,
)连接起来,可得到缓释阿司匹林,其结构如下:
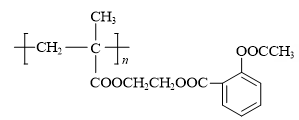 (1)、下列关于水杨酸与乙酰水杨酸的说法不正确的是( )A、1 mol水杨酸与足量的Na反应可产生1 mol H2 B、1mol乙酰水杨酸与足量NaOH溶液反应最多可消耗2 mol NaOH C、静脉滴注NaHCO3是通过调节血液的pH来达到解毒目的 D、1 mol 醋酸酐分子中含碳氧σ键数目为4 mol(2)、下列关于缓释阿司匹林制备及其性质,说法正确的是( )A、聚甲基丙烯酸能使酸性高锰酸钾溶液褪色 B、缓释阿司匹林的每个链节中含有4个碳原子 C、阿司匹林与水分子能形成氢键 D、酸性条件下,缓释阿司匹林完全水解可得到三种有机物8. 下列说法正确的是( )
(1)、下列关于水杨酸与乙酰水杨酸的说法不正确的是( )A、1 mol水杨酸与足量的Na反应可产生1 mol H2 B、1mol乙酰水杨酸与足量NaOH溶液反应最多可消耗2 mol NaOH C、静脉滴注NaHCO3是通过调节血液的pH来达到解毒目的 D、1 mol 醋酸酐分子中含碳氧σ键数目为4 mol(2)、下列关于缓释阿司匹林制备及其性质,说法正确的是( )A、聚甲基丙烯酸能使酸性高锰酸钾溶液褪色 B、缓释阿司匹林的每个链节中含有4个碳原子 C、阿司匹林与水分子能形成氢键 D、酸性条件下,缓释阿司匹林完全水解可得到三种有机物8. 下列说法正确的是( )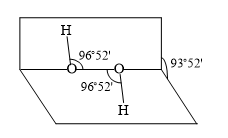 A、分子式为C9H14Cl2的有机物可能属于芳香族化合物 B、H2O2分子结构示意如图所示,H2O2为非极性分子 C、常温下,正丁烷的沸点比异丁烷的沸点低 D、相同条件下,CF3COOH溶液的酸性比CHCl2COOH溶液的酸性强9. 下列表示或分析正确的是( )A、C2H2的燃烧热为1299.6 kJ·mol-1。乙炔燃烧的热化学方程式为C2H2(g) + O2(g) = 2CO2(g) + H2O(g) ΔH=-1299.6 kJ·mol-1 B、少量CO2通入足量苯酚钠溶液:C6H5ONa + CO2 + H2O→C6H5OH + NaHCO3 C、已知:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。用E表示键能,则:E(N≡N) + 3E(H-H)-6E(N-H)=92.4 kJ·mol-1 D、硫酸铜溶液中加入过量氨水Cu2++ 2NH3·H2O = Cu(OH)2↓+ 2NH4+10. 一种从工业电解精炼铜的阳极泥(含有Se、Au、Ag、CuSe、Ag2Se等)中提取硒的过程如图所示。下列说法正确的是( )
A、分子式为C9H14Cl2的有机物可能属于芳香族化合物 B、H2O2分子结构示意如图所示,H2O2为非极性分子 C、常温下,正丁烷的沸点比异丁烷的沸点低 D、相同条件下,CF3COOH溶液的酸性比CHCl2COOH溶液的酸性强9. 下列表示或分析正确的是( )A、C2H2的燃烧热为1299.6 kJ·mol-1。乙炔燃烧的热化学方程式为C2H2(g) + O2(g) = 2CO2(g) + H2O(g) ΔH=-1299.6 kJ·mol-1 B、少量CO2通入足量苯酚钠溶液:C6H5ONa + CO2 + H2O→C6H5OH + NaHCO3 C、已知:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1。用E表示键能,则:E(N≡N) + 3E(H-H)-6E(N-H)=92.4 kJ·mol-1 D、硫酸铜溶液中加入过量氨水Cu2++ 2NH3·H2O = Cu(OH)2↓+ 2NH4+10. 一种从工业电解精炼铜的阳极泥(含有Se、Au、Ag、CuSe、Ag2Se等)中提取硒的过程如图所示。下列说法正确的是( ) A、Se的核外电子排式为[Ar]4s24p4 B、“焙烧”时,Ag2Se与O2反应每消耗1 mol O2 , 转移的电子总数为4 mol C、甲酸还原H2SeO3反应的化学方程式为:H2SeO3+2HCOOH=Se↓+2CO2↑+3H2O D、用得到的银可制得氯化银(晶胞如图所示),氯化银晶胞中Ag+周围最近且等距离的Ag+的数目为8
A、Se的核外电子排式为[Ar]4s24p4 B、“焙烧”时,Ag2Se与O2反应每消耗1 mol O2 , 转移的电子总数为4 mol C、甲酸还原H2SeO3反应的化学方程式为:H2SeO3+2HCOOH=Se↓+2CO2↑+3H2O D、用得到的银可制得氯化银(晶胞如图所示),氯化银晶胞中Ag+周围最近且等距离的Ag+的数目为8 11. 抗氧化剂香豆酰缬氨酸乙酯(Z)可由下列反应制得。
11. 抗氧化剂香豆酰缬氨酸乙酯(Z)可由下列反应制得。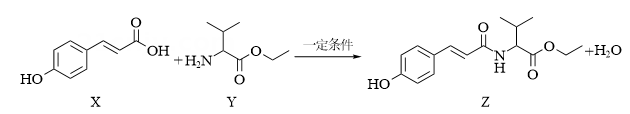
下列说法正确的( )
A、化合物Y含有的官能团为酯基和酰胺基 B、化合物X和Z可以用FeCl3溶液鉴别 C、应化合物X与足量H2反应,得到的产物含有2个手性碳原子 D、化合物Z在酸性条件下水解得到3种不同有机物12. 下列实验探究方案能达到探究目的的是( )探究方案
探究目的
A
将卤代烃与NaOH溶液加热,冷却后,向体系中加稀硝酸调节至酸性,滴加硝酸银溶液,观察沉淀颜色
确定卤代烃中卤素原子种类
B
取4 mL乙醇,加入12 mL浓硫酸及少量沸石,迅速升温至170℃,将产生的气体通入酸性高锰酸钾溶液,观察溶液颜色变化
验证乙醇发生消去反应
C
向1 mL 0.1 mol·L-1 NaOH溶液中加入2 mL 0.1 mol·L-1 CuSO4溶液,振荡后滴加0.5 mL有机物X,加热,观察是否产生砖红色沉淀
确定X中是否含有醛基结构
D
向Fe(NO3)2溶液中滴加硫酸酸化的H2O2溶液,观察溶液颜色变化
证明氧化性H2O2 > Fe3+
A、A B、B C、C D、D二、非选择题(共4题,共61分)。
-
13.(1)、已知。
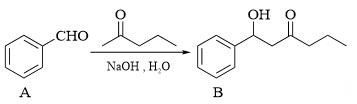
①
 的酮羰基相邻碳原子上的C-H键极性强,易断裂,原因是。
的酮羰基相邻碳原子上的C-H键极性强,易断裂,原因是。②该条件下还可能生成一种副产物,与B互为同分异构体。该副产物的结构简式是。
(2)、已知:C2H5OH(g) = C2H5OH(1) △H1=-Q1 kJ·mol-1C2H5OH(g)+3O2(g) = 2CO2(g)+3H2O(g) △H2=-Q2 kJ·mol-1
H2O(g) = H2O(l) △H3=-Q3 kJ·mol-1
则C2H5OH(l)+3O2(g) = 2CO2(g)+3H2O(l) △H=kJ·mol-1(用含有Q1、Q2、Q3的式子表示),若将23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为kJ。
(3)、①Cu与N两种元素组成的化合物具有良好光学性能。其晶胞结构如图所示。该物质的化学式为。
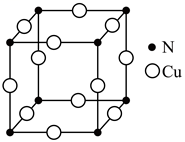
②CuBr2的水溶液呈蓝色,蓝色物质为水合铜离子,可表示为 [Cu(H2O)4]2+ , 1 mol [Cu(H2O)4]2+含有σ键的数目为。[Cu(H2O)4]2+的结构式可表示为。
14. ClO2是一种安全稳定、高效低毒的广谱型消毒剂,它易溶于水、难溶于有机溶剂,高浓度的ClO2气体易爆炸。常见制备ClO2的方法如下:(1)、Ⅰ.利用NaClO2与纯净的Cl2反应可制得ClO2和NaCl,实验装置如图所示(夹持装置略)。
装置B中试剂为。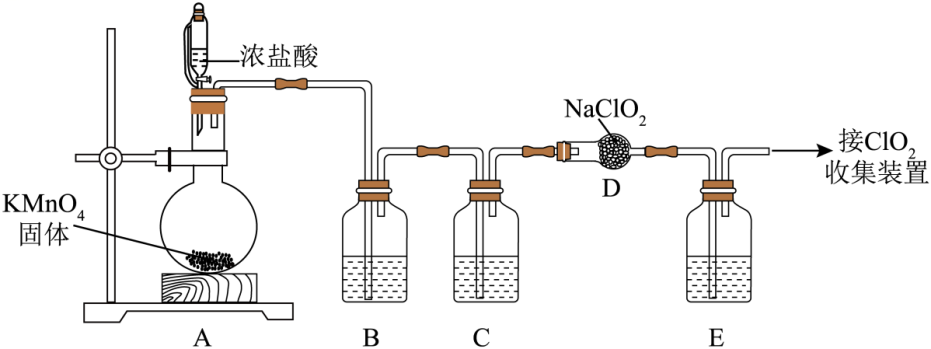 (2)、装置E中所盛试剂是CCl4 , 其作用为。(3)、Ⅱ.草酸(H2C2O4)、氯酸钾和适当浓度的H2SO4溶液反应制取ClO2 , 反应的化学方程式为
(2)、装置E中所盛试剂是CCl4 , 其作用为。(3)、Ⅱ.草酸(H2C2O4)、氯酸钾和适当浓度的H2SO4溶液反应制取ClO2 , 反应的化学方程式为2KClO3+H2C2O4 = K2CO3+CO2↑+2ClO2↑+H2O。
该方法制备ClO2的优点是。
(4)、Ⅲ.以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2 , 再用水吸收获得ClO2溶液。在ClO2的制备和吸收过程中均需要控制适宜的温度,如图所示为温度对ClO2纯度、吸收率的影响。
已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42- , 写出该法制备ClO2
气体的离子方程式: , 由图可知,反应时采取的适宜措施是。
(5)、某校化学学习小组拟以“”作为衡量ClO2产率的指标。取NaClO3样品质量6.750 g,通过反应和吸收可得400.00 mL ClO2溶液,取出20.00 mL,加入37 mL 0.5000 mol·L-1 (NH4)2Fe(SO4)2溶液充分反应,过量Fe2+再用0.05000 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:4H++ ClO2 + 5Fe2+= Cl-+ 5Fe3++ 2H2O;
H++ Fe2++ Cr2O―― Cr3++ Fe3++ H2O (未配平),试计算ClO2的产率
15. 本维莫德(G)是治疗湿疹的非激素类外用药,其合成路线如下: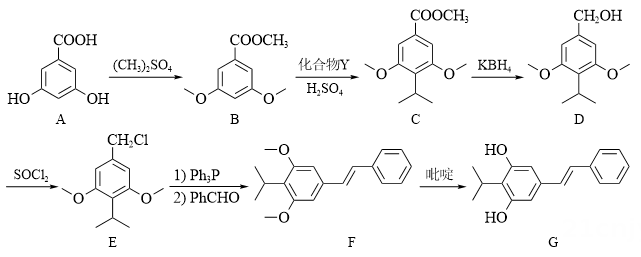
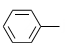
其中,-Ph为苯基(
 , 即苯失去一个H得到的原子团 )。(1)、室温下,在水中A的溶解度比B的(填“大”或“小”或“无差别”)。(2)、A→B的主要目的为。(3)、Y的分子式为C3H8O,其结构简式为。(4)、B→C的反应类型为。(5)、B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式。
, 即苯失去一个H得到的原子团 )。(1)、室温下,在水中A的溶解度比B的(填“大”或“小”或“无差别”)。(2)、A→B的主要目的为。(3)、Y的分子式为C3H8O,其结构简式为。(4)、B→C的反应类型为。(5)、B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式。碱性条件下水解后酸化生成两种产物。一种产物含有苯环,其核磁共振氢谱只有2组峰;另一种产物能与银氨溶液反应,被氧化为碳酸后分解生成二氧化碳和水。
(6)、写出以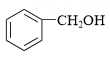 为原料制备
为原料制备 的合成路线流程图(须用Ph3P,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 16. 柠檬酸亚铁(FeC6H6O7)是一种易被人体吸收的高效铁制剂, 医疗上可以用来治疗缺铁性贫血。某课题组以硫铁矿烧渣(含 Fe2O3、SiO2、少量Al2O3等)为原料,先制备碳酸亚铁,再与柠檬酸反应可以制得柠檬酸亚铁。其工艺流程如下:
的合成路线流程图(须用Ph3P,无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。 16. 柠檬酸亚铁(FeC6H6O7)是一种易被人体吸收的高效铁制剂, 医疗上可以用来治疗缺铁性贫血。某课题组以硫铁矿烧渣(含 Fe2O3、SiO2、少量Al2O3等)为原料,先制备碳酸亚铁,再与柠檬酸反应可以制得柠檬酸亚铁。其工艺流程如下:
已知:调节溶液的pH可以使水溶液中的金属离子形成氢氧化物沉淀,下表为相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子
Al3+
Fe2+
Fe3+
沉淀开始pH
3.1
5.9
1.2
沉淀完全 pH
5.1
6.9
3.2
(1)、基态Fe价电子排布式为。Si处于元素周期表的区。(2)、“浸泡”时加入过量硫酸的目的:。(3)、“除杂”时有同学提出下列两种途径,途径一:
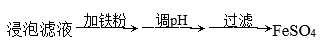
途径二:
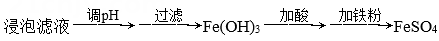
①请选择较合理的途径并说明理由。
②“加铁粉”时发生主要反应的离子方程式。
(4)、“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如图:
Na2CO3溶液的浓度大于 4 mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是。
(5)、已知柠檬酸亚铁易被氧化,能溶于水,不溶于乙醇。设计试验方案,从“制备FeCO3”中得到的FeCO3制备柠檬酸亚铁晶体: , 静置、过滤、洗涤、干燥, 获得柠檬酸亚铁晶体。(必须用到的试剂有:Fe粉、柠檬酸溶液、无水乙醇)