安徽省滁州市九校联盟2023-2024学年高一上学期11月期中考试化学试题
试卷更新日期:2024-03-01 类型:期中考试
一、选择题(本题共14小题,每小题3分,共计42分。在每小题列出的四个选项中,只有一项是符合题目要求的)
-
1. 我国古代文化博大精深,下列与化学有关的描述涉及氧化还原反应的是( )A、《荀子·劝学》中“冰,水为之,而寒于水,木直中绳……”描述人类对结冰的认识 B、《寒食》中“日暮汉宫传蜡烛,轻烟散入五侯家。”描述蜡烛燃烧的情况 C、《晚春二首·其二》中“榆荚只能随柳絮,等闲撩乱走空园。”描述榆荚随柳絮飘荡的画面 D、《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露。”描述蒸馏的过程2. 下列各组微粒中,属于同素异形体的是( )A、水与双氧水 B、氢气与液氢 C、氧气与臭氧 D、纯碱与烧碱3. 单宁是一种天然防腐剂,可以有效避免葡萄酒因为被氧化而变酸,下列有关判断正确的是( )A、单宁作还原剂 B、单宁作氧化剂 C、单宁被还原 D、单宁中某元素化合价降低4. 下列物质在水溶液或熔融状态下的电离方程式正确的是( )A、 B、 C、 D、NaCl(爆炸)5. 化学来源于生活,也服务于生活。下列关于氯及其化合物的叙述正确的是( )A、难溶于水,一般用排水法收集 B、漂白粉的有效成分为NaClO C、性质活泼,与Fe反应生成 D、HClO不稳定,光照条件下分解产生6. 下列转化过程加入氧化剂的是( )A、 B、 C、 D、7. 下列氧化还原反应中,电子转移的方向和数目均正确的是( )A、
 B、
B、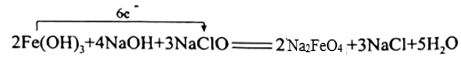 C、
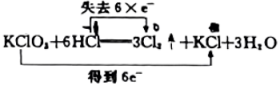
C、 D、
D、 8. 下列各组离子在溶液中能大量共存的是( )A、、 , , B、、 , 、 C、 , 、 , D、、 , ,9. 下列实验或装置不能达到实验目的的是( )
8. 下列各组离子在溶液中能大量共存的是( )A、、 , , B、、 , 、 C、 , 、 , D、、 , ,9. 下列实验或装置不能达到实验目的的是( )A
B
C
D



验证NaCl是否是电解质
比较碳酸钠和碳酸氢钠的热稳定性
测定新制氯水的pH
区分溶液与胶体
A、A B、B C、C D、D10. 钠元素广泛存在于自然界,下列关于钠及其化合物的叙述正确的是( )A、金属钠着火时,可用二氧化碳来扑灭 B、将少量钠投入氯化镁溶液中,可得到金属镁 C、用碳酸氢钠溶液做焰色试验,焰色为黄色 D、可用澄清石灰水鉴别碳酸钠和碳酸氢钠溶液11. 下列离子方程式中书写正确的是( )A、向中滴加少量稀盐酸: B、向NaOH溶液中通入少量: C、向水中投入一小块钠: D、向水中投入少量:12. 物质的性质决定用途,下列物质的性质与其用途正确且具有对应关系的是( )A、盐酸具有挥发性,可用于除铁锈 B、NaCl熔点高,可用于食品防腐 C、乙醇具有可燃性,可用作燃料 D、具有强还原性,可用于自来水消毒13. 某溶液只含有、、、四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中和的离子个数比为( )A、1∶1 B、2∶3 C、3∶4 D、5∶214. “宏观辨识—微观探析——符号表征”是化学学习的重要方法。某化学反应的微观示意图如下,下列分析错误的是( )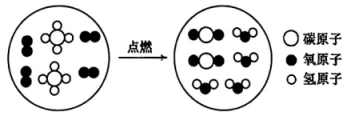 A、该反应属于氧化还原反应 B、
A、该反应属于氧化还原反应 B、 为温室气体
C、该反应实现了无机物向有机物的转化
D、该反应的化学方程式为
为温室气体
C、该反应实现了无机物向有机物的转化
D、该反应的化学方程式为
二、非选择题(本题共4小题,共58分)
-
15. 钠及其化合物在日常生活中有许多重要应用。回答下列问题:
Ⅰ.如图为钠的价类二维图。
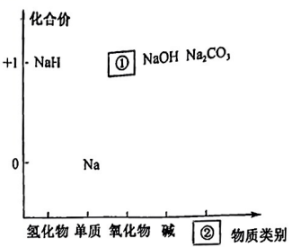 (1)、
(1)、Ⅰ.如图为钠的价类二维图。
若①处是淡黄色固体,其化学式为 , ②处所属的物质类别为。 (2)、氢化钠(NaH)能与水反应生成氢氧化钠和氢气,写出该反应的化学方程式:。(3)、钠钾合金可用作原子反应堆的导热剂的原因除了钠钾合金是难气化的液态合金,还有可能是。(4)、Ⅱ.我国化学家侯德榜发明了联合制碱法(),对世界制碱工业做出了巨大贡献。联合制碱法的主要流程如图所示(部分物质已略去,极易溶于水,其水溶液呈碱性)。
(2)、氢化钠(NaH)能与水反应生成氢氧化钠和氢气,写出该反应的化学方程式:。(3)、钠钾合金可用作原子反应堆的导热剂的原因除了钠钾合金是难气化的液态合金,还有可能是。(4)、Ⅱ.我国化学家侯德榜发明了联合制碱法(),对世界制碱工业做出了巨大贡献。联合制碱法的主要流程如图所示(部分物质已略去,极易溶于水,其水溶液呈碱性)。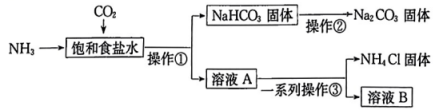
流程图中标注的物质属于电解质的有种,①~③所涉及的操作方法中,包含过滤的是(填序号)。
(5)、煅烧固体的化学方程式为。(6)、关于上述流程,下列说法中正确的是(填字母)。a.两种气体的先后顺序为先通入再通入
b.先析出的原因是的溶解度小于
c.整个流程中涉及氧化还原反应
d.溶液B中的主要离子为 , , ,
16. 氧化还原反应是一类重要的化学反应,广泛存在于生产、生活中。回答下列问题: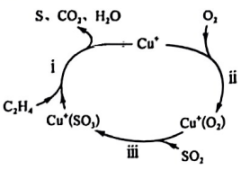 (1)、以乙烯()脱硫的方法治理燃煤尾气中的 , 其机理如图所示。过程Ⅰ、Ⅱ、Ⅲ中涉及氧化还原反应的是 , 图中涉及的物质属于酸性氧化物的是(填化学式)。(2)、某工业废水含有大量对人体健康有危害的 , 为了降低废水中的浓度,可以在碱性条件下用铝粉将转化为 , 其化学方程式为。
(1)、以乙烯()脱硫的方法治理燃煤尾气中的 , 其机理如图所示。过程Ⅰ、Ⅱ、Ⅲ中涉及氧化还原反应的是 , 图中涉及的物质属于酸性氧化物的是(填化学式)。(2)、某工业废水含有大量对人体健康有危害的 , 为了降低废水中的浓度,可以在碱性条件下用铝粉将转化为 , 其化学方程式为。①中Al的化合价为。
②上述反应中,被氧化的元素是(填元素符号),被氧化的元素(填“得到”或“失去”)电子;还原产物的化学式为。
③反应中每生成1个 , 转移个电子。
(3)、“假黄金”实际上是铜合金,可用稀硝酸鉴别。配平该反应的化学方程式(稀):。(4)、已知、 , 均有还原性,它们在酸性溶液中会发生如下反应:①
②
③
则、 , 的还原性由强到弱的顺序为(用“>”连接)。
17. 某澄清透明溶液中可能含 , , , , , , , 中的一种或几种(不考虑离子水解),现进行如下实验:①用玻璃棒蘸取少量溶液滴在红色石蕊试纸上,试纸变蓝;
②取少量原溶液于试管中,逐滴滴加盐酸至过量,有气体放出;
③再向②所得溶液中加入溶液,没有沉淀生成;
④再向③所得溶液中滴加足量硝酸酸化后,加入溶液,有白色沉淀生成。
回答下列问题:
(1)、根据步骤①可以推断原溶液中一定含有 , 一定不含有。(2)、步骤②发生反应的离子方程式为。(3)、根据步骤②、③可以推断出原溶液中一定含有 , 一定不含有。(4)、步骤④中产生的白色沉淀为(填化学式)。(5)、通过步骤④不能确定原溶液中含有 , 其原因是。18. 某校化学兴趣小组为验证氯气的性质,设计如下实验(夹持装置已省略)。
已知:装置A中发生反应的化学方程式为(浓)。
回答下列问题:
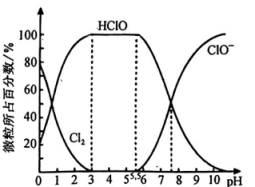
(1)、写出装置B中反应的化学方程式:;实验结束后,立即取装置B中溶液滴在紫色石蕊试纸上,可观察到的现象是。(2)、装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ处应放入(填“干燥的有色布条”或“湿润的有色布条”)。(3)、装置D中多孔球泡的作用为;与石灰乳的反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是。(4)、装置E的作用是。(5)、可用于饮用水消毒。溶于水得到氯水,氯水中HClO的浓度越大杀菌能力越强。已知25℃时,氯水中(溶于水的氯气分子)、HClO、三种微粒所占百分数与溶液pH的关系如图所示。则用处理饮用水时,溶液的pH最佳控制范围是。