云南省玉溪市2023-2024学年高二上学期期末教学质量检测化学试题
试卷更新日期:2024-02-01 类型:期末考试
一、选择题(本大题共14小题,每小题3分,共42分.在每小题给出的四个选项中,只有一项是符合题目要求的)
-
1. 建设美丽乡村,守护中华家园,衣食住行皆化学.下列说法错误的是( )A、爆竹烟花迎佳节,烟花呈现的是锂钠钾锶钡等金属元素的焰色 B、乡村公路铺沥青,沥青属于石油加工产品 C、千家万户通光纤,光纤的主要材质为 D、均衡膳食助健康,主食中的淀粉可水解为葡萄糖2. 下列有关化学用语正确的是( )A、的电离方程式: B、氯分子的电子式: C、次氯酸的结构式: D、氟原子的结构示意图:
 3. 相同温度下,等物质的量浓度的下列溶液中,值最小的是( )A、 B、 C、 D、4. 宏观辨识与微观探析是化学学科核心素养之一,下列反应的离子方程式书写错误的是( )A、漂白粉溶液吸收后产生白色沉淀: B、氯气通入氢氧化钠溶液制“84”消毒液: C、过氧化钠溶于水制氧气: D、用氯化铁溶液蚀刻覆铜板:5. 为阿伏加德罗常数的值.下列说法正确的是( )A、过氧化钠中阴离子数为 B、溶液中含有的数为 C、 , 含有个中子 D、(标准状况)苯在中完全燃烧,得到个分子6. 2024年的奥运会将在巴黎举行,沙滩排球比赛场地将设在埃菲尔铁塔前的战神广场,埃菲尔铁塔为钢铁结构,使用了250万个铆钉和近两万块铁片,下列说法正确的是( )A、连接铁片的铆钉应该用铜质的 B、巴黎的气候比较潮湿,不易引起钢铁的生锈 C、为了减缓钢铁生锈,可以在铁塔表面镀一层锡 D、在铁塔表面涂上一层特制的油漆,能有效保护金属7. 离子鉴别能让我们感受微观世界的神奇.下列各组离子在给定溶液中能大量共存的是( )A、滴加几滴溶液显血红色的溶液中: B、无色透明溶液中: C、的溶液中: D、能使酚酞变红的溶液中:8. 反应在恒温恒容下达到平衡,下列说法可以作为该反应已达到平衡的判据是( )A、气体的总物质的量不变 B、气体的总质量不变 C、与的浓度相同 D、容器内气体的密度不变9. 短周期主族元素a、b、c、d原子序数依次增大,d是短周期中金属性最强的元素,c是地壳中含量最多的元素,只有b、c处于同一周期且相邻.下列说法错误的是( )A、原子半径: B、d的最高价氧化物对应的水化物是一种强碱 C、c的单质的氧化性比b的强 D、a、b、c三种元素可以组成共价化合物和离子化合物10. 在空气中与的反应是分两步完成的,其反应过程如图所示,下列有关说法错误的是( )
3. 相同温度下,等物质的量浓度的下列溶液中,值最小的是( )A、 B、 C、 D、4. 宏观辨识与微观探析是化学学科核心素养之一,下列反应的离子方程式书写错误的是( )A、漂白粉溶液吸收后产生白色沉淀: B、氯气通入氢氧化钠溶液制“84”消毒液: C、过氧化钠溶于水制氧气: D、用氯化铁溶液蚀刻覆铜板:5. 为阿伏加德罗常数的值.下列说法正确的是( )A、过氧化钠中阴离子数为 B、溶液中含有的数为 C、 , 含有个中子 D、(标准状况)苯在中完全燃烧,得到个分子6. 2024年的奥运会将在巴黎举行,沙滩排球比赛场地将设在埃菲尔铁塔前的战神广场,埃菲尔铁塔为钢铁结构,使用了250万个铆钉和近两万块铁片,下列说法正确的是( )A、连接铁片的铆钉应该用铜质的 B、巴黎的气候比较潮湿,不易引起钢铁的生锈 C、为了减缓钢铁生锈,可以在铁塔表面镀一层锡 D、在铁塔表面涂上一层特制的油漆,能有效保护金属7. 离子鉴别能让我们感受微观世界的神奇.下列各组离子在给定溶液中能大量共存的是( )A、滴加几滴溶液显血红色的溶液中: B、无色透明溶液中: C、的溶液中: D、能使酚酞变红的溶液中:8. 反应在恒温恒容下达到平衡,下列说法可以作为该反应已达到平衡的判据是( )A、气体的总物质的量不变 B、气体的总质量不变 C、与的浓度相同 D、容器内气体的密度不变9. 短周期主族元素a、b、c、d原子序数依次增大,d是短周期中金属性最强的元素,c是地壳中含量最多的元素,只有b、c处于同一周期且相邻.下列说法错误的是( )A、原子半径: B、d的最高价氧化物对应的水化物是一种强碱 C、c的单质的氧化性比b的强 D、a、b、c三种元素可以组成共价化合物和离子化合物10. 在空气中与的反应是分两步完成的,其反应过程如图所示,下列有关说法错误的是( )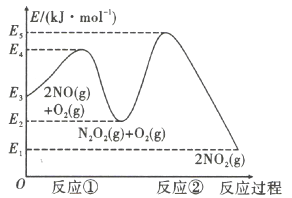 A、反应①的方程式为 , 且为放热反应 B、反应的活化能为 C、第二步反应是该反应的决速步骤 D、如果加入合适的催化剂,可以改变该反应的11. 下列实验、现象及结论都正确的是( )
A、反应①的方程式为 , 且为放热反应 B、反应的活化能为 C、第二步反应是该反应的决速步骤 D、如果加入合适的催化剂,可以改变该反应的11. 下列实验、现象及结论都正确的是( )选项
实验
现象
结论
A
用试纸测定“84”消毒液的
试纸最终显蓝色
在溶液中水解显碱性
B
向盛有溶液的试管中滴加2滴硝酸银溶液,震荡试管,然后向其中滴加4滴溶液
先产生白色沉淀,然后白色沉淀转化为黄色沉淀
C
向溶液中滴加溶液
溶液褪色
具有氧化性
D
向溶液中通入和X气体
产生白色沉淀
气体X一定具有强氧化性
A、A B、B C、C D、D12. 下列说法正确的是( )A、为了配制浓度与的浓度比为的溶液,可在溶液中加入适量的盐酸 B、溶于的离子方程式: C、中和相同、相同体积的溶液和氨水,消耗盐酸中的物质的量相同 D、氨水和溶液等体积混合后所得溶液 , 则13. 时将和充入容积为的恒容密闭容器中,发生反应后达到平衡,B的转化率为50%.若温度不变,将容器的容积缩小为原来的一半,A的转化率不发生变化.下列说法正确的是( )A、 B、该温度下,此反应达平衡时的化学平衡常数 C、内 D、平衡后,若升高温度,重新达到平衡,A的转化率减小14. 常温下,向相同体积、相同浓度的和溶液中分别滴加的盐酸,溶液变化如图所示,下列说法正确的是( ) A、图甲是的滴定曲线 B、A、B、C均满足: C、水的电离程度: D、点溶液中的微粒满足关系式:
A、图甲是的滴定曲线 B、A、B、C均满足: C、水的电离程度: D、点溶液中的微粒满足关系式:二、填空题(本大题共4小题,共58分)
-
15. 食醋是烹饪美食的调味品,有效成分主要为乙酸,回答下列问题:(1)、乙酸俗称醋酸,乙酸可凝结为类似冰一样的晶体,又叫 , 乙酸的官能团是(写名称).(2)、实验室常用图装置制备乙酸乙酯.

①a试管中装有乙酸、无水乙醇、浓硫酸,b试管中液体是 , 浓硫酸的作用是 , a试管中主要反应的化学方程式为 .
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是 .
(3)、醋酸能除水垢 , 写出该反应的离子方程式: .(4)、 , 将的醋酸溶液加水稀释,请填写下列表达式中的数据情况(填“变大”“变小”或“不变”).①;②;③ .
(5)、室温下,醋酸溶液 , 则该温度下醋酸电离平衡常数 , 约为 .16. 可作为紫外线吸收剂应用于化妆品中.某工厂采用如图所示工艺处理工厂废渣(主要成分为 , 另含少量等)制取高纯 . 回答下列问题: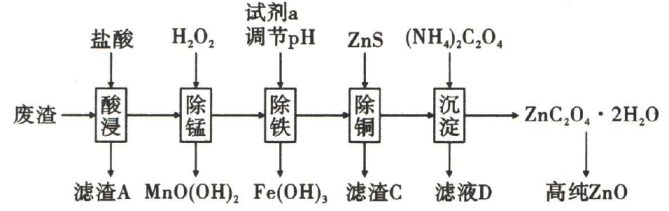
已知:①草酸受热易分解生成;
②常温下: .
(1)、提高酸浸速率的措施有(写一条即可).(2)、“滤渣A”的主要成分为 .(3)、的电子式为 .(4)、试剂a为 , “滤液D”中主要含有的离子有 .(5)、写出“除锰”中,生成的离子方程式: .(6)、写出由制得氧化锌的化学方程式: .(7)、“除锰”后滤液中 , “除铁”操作中可以调节的范围是 .17. 我国提出2060年达“碳中和”目标.(1)、Ⅰ.还原是实现“双碳”经济的有效途径之一,相关的主要反应有:
①
②
请回答:
有利于提高平衡转化率的条件是____(填序号).A、低温低压 B、低温高压 C、高温低压 D、高温高压(2)、反应的 , (用表示).(3)、恒压、时,和按物质的量之比投料,反应经如图所示流程(主要产物已标出)可实现高效转化.
下列说法正确的是____(填序号).
A、过程ii,吸收可促使氧化的平衡正移 B、过程ii产生的最终未被吸收,在过程iii被排出 C、可循环利用,不可循环利用 D、相比于反应①,该流程的总反应还原需吸收的能量更多(4)、Ⅱ.近年研究发现,电催化和含氮物质(等)在常温常压下合成尿素,有助于实现碳中和及解决含氮废水污染问题.向一定浓度的溶液通至饱和,在电极上反应生成 , 电解原理如图所示.
电极b是电解池的极,电极反应式为 .
(5)、电解过程中生成尿素的电极反应式是 .18. 化学反应常伴随热效应.某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式计算获得.(1)、盐酸浓度的测定:用溶液测定未知浓度的盐酸,其操作可分解为如下几步:A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取盐酸 , 注入锥形瓶中,加入酚酞作指示剂
D.另取锥形瓶,再重复操作次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准溶液润洗后,将标准液注入碱式滴定管“0”刻度以上处,调节液面至“0”刻度或“0”刻度以下,再把碱式滴定管固定好
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定时正确的操作顺序是(填序号)E→→F→→C→→D.
②上述滴定操作用到的仪器有(填序号).

③滴定时边滴边摇动锥形瓶,眼睛应注意观察 . 滴定终点溶液颜色的变化是 .
④滴定结果如下表所示:
滴定次数
待测液体积/
标准溶液的体积/
滴定前读数
滴定后读数
1
20.00
1.03
23.03
2
20.00
0.60
22.60
3
20.00
0.20
20.19
则该盐酸浓度为 .
⑤若碱式滴定管用蒸馏水洗净后,未经标准液润洗就注入标准溶液,则测定结果将(填“偏高”“偏低”或“不变”).
(2)、热量的测定:取上述溶液和盐酸各进行反应,测得反应前后体系的温度值(℃)分别为 , 则该过程放出的热量为J(c和ρ分别取和 , 忽略水以外各物质吸收的热量).