山东省临沂市2023届高三下学期一模考试化学试题
试卷更新日期:2023-03-08 类型:高考模拟
一、单选题
-
1. 化学与生产、生活、科技密切相关。下列说法错误的是A、硅胶、生石灰均可用作食品干燥剂 B、葡萄糖在酒化酶的作用下发生水解反应生成乙醇 C、将CO2还原为甲醇,有利于实现“碳中和” D、焰火、激光都与原子核外电子跃迁释放能量有关2. 古文献《余冬录》中对胡粉[主要成分为2PbCO3•Pb(OH)2]制法的相关描述:“铅块悬酒缸内,封闭四十九日,开之则化为粉矣。化不白者(Pb),炒为黄丹(Pb3O4)。黄丹滓为密陀僧(PbO)”。下列说法错误的是A、2PbCO3•Pb(OH)2属于碱式盐 B、Pb3O4与硫酸反应只生成PbSO4和水 C、“化不白者,炒为黄丹”的过程中发生了氧化还原反应 D、密陀僧与碳粉高温加热可以制得铅3. 实验室中下列做法错误的是A、金属钠着火时使用泡沫灭火器灭火 B、高锰酸钾固体保存在棕色广口瓶中 C、配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加入水稀释 D、浓硫酸沾到皮肤上,立即用大量水冲洗,然后用3%~5%NaHCO3溶液冲洗4. 我国科研工作者利用冷冻透射电子显微镜同步辐射等技术,在还原氧化石墨烯膜上直接观察到了自然环境下生成的某二维晶体,其结构如图所示。下列说法正确的是
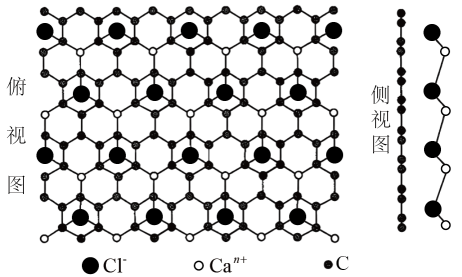 A、该二维晶体的化学式为CaCl2 B、Ca-Cl-Ca的键角为60° C、Can+和Cl-的配位数均为3 D、该晶体可由钙在氯气中燃烧制得5. 异黄酮类化合物是药用植物的有效成分之一,一种异黄酮类化合物X的结构如图所示。下列说法错误的是
A、该二维晶体的化学式为CaCl2 B、Ca-Cl-Ca的键角为60° C、Can+和Cl-的配位数均为3 D、该晶体可由钙在氯气中燃烧制得5. 异黄酮类化合物是药用植物的有效成分之一,一种异黄酮类化合物X的结构如图所示。下列说法错误的是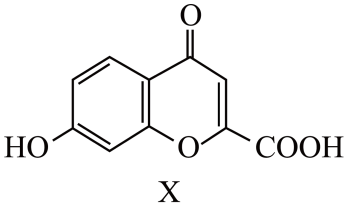 A、X分子中环上氧原子的杂化方式为sp2 B、X分子中所有碳原子共平面 C、X分子中有6种不同化学环境的氢原子 D、1molX最多与3molBr2反应6. KMnO4是一种常用的氧化剂,某实验小组利用Cl2氧化K2MnO4制备KMnO4装置如图所示(夹持装置略)。
A、X分子中环上氧原子的杂化方式为sp2 B、X分子中所有碳原子共平面 C、X分子中有6种不同化学环境的氢原子 D、1molX最多与3molBr2反应6. KMnO4是一种常用的氧化剂,某实验小组利用Cl2氧化K2MnO4制备KMnO4装置如图所示(夹持装置略)。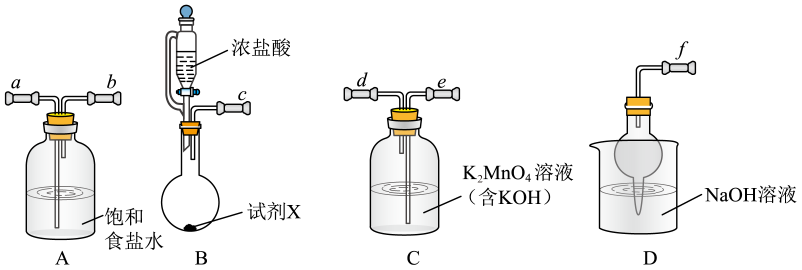
已知:K2MnO4在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
3MnO+2H2O=2MnO+MnO2↓+4OH-。
下列说法错误的是
A、试剂X可以是漂白粉或KClO3 B、装置连接顺序是c→a→b→e→d→f C、装置C中每生成1molKMnO4 , 消耗0.5molCl2 D、若去掉装置A,会导致KMnO4产率降低7. 正丁醛经催化加氢可得到含少量正丁醛的1-丁醇粗品,为提纯1-丁醇设计如图路线。
已知:①1-丁醇微溶于水,易溶于乙醚;
②R-CHO+NaHSO3(饱和)→R-CH(OH)SO3Na↓。
下列说法错误的是
A、试剂a为饱和NaHSO3溶液,试剂b为乙醚 B、操作I和操作III均为过滤 C、无水MgSO4的作用是干燥除水 D、蒸馏时冷却水应从球形冷凝管的上口进入8. M、N、Z、Y、X、T是原子半径依次增大的短周期主族元素,基态N原子核外电子有5种空间运动状态,并有1个单电子,这六种元素形成的一种化合物结构如图所示。下列说法正确的是
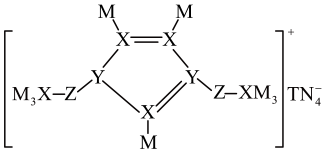 A、与Y同周期且第一电离能大于Y的元素仅有1种 B、该化合物中含有离子键、共价键和配位键 C、六种元素中,X的最高价含氧酸的酸性最强 D、M与X、Y形成的化合物中,前者的沸点一定低于后者9. 实验室以工业废渣(主要含CaSO4•2H2O,还含少量SiO2)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如图。下列说法正确的是
A、与Y同周期且第一电离能大于Y的元素仅有1种 B、该化合物中含有离子键、共价键和配位键 C、六种元素中,X的最高价含氧酸的酸性最强 D、M与X、Y形成的化合物中,前者的沸点一定低于后者9. 实验室以工业废渣(主要含CaSO4•2H2O,还含少量SiO2)为原料制取轻质CaCO3和(NH4)2SO4晶体,其实验流程如图。下列说法正确的是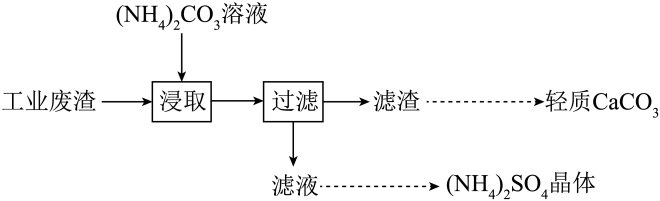 A、为提高浸取效率,浸取时需在高温下进行 B、浸取时,需向(NH4)2CO3溶液中加入适量浓氨水,抑制水解 C、滤渣经洗涤和干燥后得纯净的轻质CaCO3 D、对滤液进行蒸发浓缩、冷却结晶可得到纯净的(NH4)2SO4晶体10. 利用库仑测硫仪测定气体中SO2的体积分数,其原理如图所示。待测气体进入电解池后,SO2将I还原,测硫仪便自动电解,溶液中保持不变。若有标准状况下VmL气体通入电解池(其它气体不反应),反应结束后消耗x库仑电量(已知:电解转移1mol电子所消耗的电量为96500库仑)。下列说法正确的是
A、为提高浸取效率,浸取时需在高温下进行 B、浸取时,需向(NH4)2CO3溶液中加入适量浓氨水,抑制水解 C、滤渣经洗涤和干燥后得纯净的轻质CaCO3 D、对滤液进行蒸发浓缩、冷却结晶可得到纯净的(NH4)2SO4晶体10. 利用库仑测硫仪测定气体中SO2的体积分数,其原理如图所示。待测气体进入电解池后,SO2将I还原,测硫仪便自动电解,溶液中保持不变。若有标准状况下VmL气体通入电解池(其它气体不反应),反应结束后消耗x库仑电量(已知:电解转移1mol电子所消耗的电量为96500库仑)。下列说法正确的是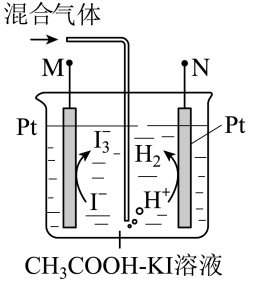 A、M接电源的负极 B、阳极反应式为2H++2e-=H2↑ C、反应结束后溶液的pH增大 D、混合气体中SO2的体积分数为×100%11. 化合物Y是一种天然除草剂,其结构如图所示。下列说法错误的是
A、M接电源的负极 B、阳极反应式为2H++2e-=H2↑ C、反应结束后溶液的pH增大 D、混合气体中SO2的体积分数为×100%11. 化合物Y是一种天然除草剂,其结构如图所示。下列说法错误的是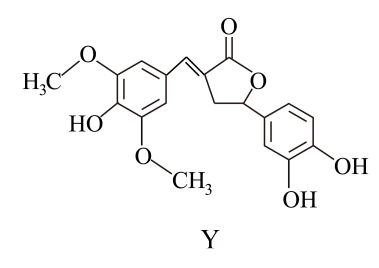 A、Y中含氧官能团有3种 B、1molY最多消耗4molNaOH C、Y可发生取代、加成、消去反应 D、Y与足量H2加成后,产物分子中含5个手性碳原子12. 根据下列实验操作和现象所得出的结论正确的是
A、Y中含氧官能团有3种 B、1molY最多消耗4molNaOH C、Y可发生取代、加成、消去反应 D、Y与足量H2加成后,产物分子中含5个手性碳原子12. 根据下列实验操作和现象所得出的结论正确的是选项
实验操作和现象
结论
A
向2mL1mol•L-1硼酸溶液中加入1mL1mol•L-1碳酸钠溶液,溶液无明显变化
硼酸与碳酸钠不反应
B
将铜丝灼烧至表面变黑,伸入盛有某有机物的试管中,铜丝恢复亮红色
该有机物中含有醇羟基
C
充分加热铁粉和硫粉的混合物,冷却后取少量固体于试管中,加入足量稀硫酸,再滴入K3[Fe(CN)6]溶液,产生蓝色沉淀
铁被硫氧化至Fe(II)
D
向新制硫酸亚铁溶液中滴加邻二氮菲(
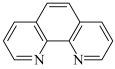 ),溶液变为橙红色,然后再加入酸,溶液颜色变浅(与加入等量水比较)
),溶液变为橙红色,然后再加入酸,溶液颜色变浅(与加入等量水比较)与邻二氮菲配位能力:H+>Fe2+
A、A B、B C、C D、D13. 一种光照充电电池结构如图所示,充电时TiO2光辅助电极受光激发产生电子和空穴,空穴作用下NaI转化为NaI3。下列说法正确的是 A、充电过程中,光能最终转化为电能 B、充电效率与光照产生的电子和空穴量有关 C、放电时,电极M为正极,电极反应为S+6e-=4S2- D、放电时N电极室增加2mol离子,理论上外电路转移1mol电子14. 某钒催化剂在一定条件下形成相邻的氧化还原位和酸性吸附位,该催化剂催化NH3脱除电厂烟气中NO的反应机理如图所示。
A、充电过程中,光能最终转化为电能 B、充电效率与光照产生的电子和空穴量有关 C、放电时,电极M为正极,电极反应为S+6e-=4S2- D、放电时N电极室增加2mol离子,理论上外电路转移1mol电子14. 某钒催化剂在一定条件下形成相邻的氧化还原位和酸性吸附位,该催化剂催化NH3脱除电厂烟气中NO的反应机理如图所示。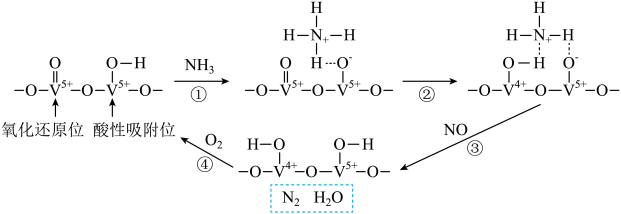
下列说法正确的是
A、反应①~④均为氧化还原反应 B、反应②为NH+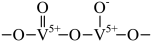 =NH+
=NH+ 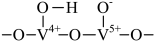 C、消耗0.5molO2 , 理论上可处理1molNO
D、总反应方程式为4NH3+6NO5N2+6H2O
15. 室温下,亚砷酸[As(OH)3]和酒石酸(H2T)混合体系中部分微粒的c-pH关系如图所示(浓度:总As为5.0×10-4mol•L-1 , 总T为1.0×10-3mol•L-1)。
C、消耗0.5molO2 , 理论上可处理1molNO
D、总反应方程式为4NH3+6NO5N2+6H2O
15. 室温下,亚砷酸[As(OH)3]和酒石酸(H2T)混合体系中部分微粒的c-pH关系如图所示(浓度:总As为5.0×10-4mol•L-1 , 总T为1.0×10-3mol•L-1)。已知:Ka1(H2T)=10-3.04 , Ka2(H2T)=10-4.37。
下列说法正确的是
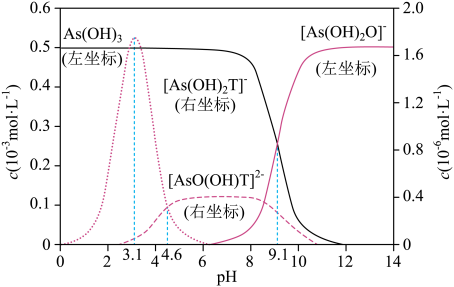 A、Ka1[As(OH)3]的数量级为10-10 B、HT-的酸性强于[As(OH)2T]- C、pH=3.1时,溶液中浓度最高的微粒为[As(OH)2T]- D、向H2T溶液中滴加NaOH溶液至中性时:c(HT-)>c(T2-)
A、Ka1[As(OH)3]的数量级为10-10 B、HT-的酸性强于[As(OH)2T]- C、pH=3.1时,溶液中浓度最高的微粒为[As(OH)2T]- D、向H2T溶液中滴加NaOH溶液至中性时:c(HT-)>c(T2-)二、综合题
-
16. 铁及其化合物在生产、生活中有重要应用。回答下列问题:(1)、基态Fe3+的价电子排布式为。(2)、某铁的配合物结构如图1所示,可由(CH3)3SiCl与K[Fe(C5H5)(CO)2CO2]混合加热制得。

①在(CH3)3SiCl、(CH3)3SiF、(CH3)4Si中,C-Si-C键角最大的是 , 原因是。
②C5H表示环戊二烯负离子,已知分子中的大π键可用符号π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π),则C5H中的大π键应表示为。
③该铁的配合物中碳原子的杂化方式共有种。
(3)、普鲁士蓝晶体属立方晶系,晶胞棱长为apm。铁-氰骨架组成小立方体,Fe粒子在顶点,CN-在棱上,两端均与Fe相连,立方体中心空隙可容纳K+ , 如图2所示(CN-在图中省略)。
①普鲁士蓝中Fe2+与Fe3+个数之比为;该晶胞的化学式为。
②若所有铁粒子为等径小球,则K+与Fe2+之间最近距离为pm;该晶体的密度为g•cm-3(阿伏加德罗常数为NA)。
17. 钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。工业上利用固体废料“赤泥”(含FeO、Fe2O3、SiO2、Sc2O3、TiO2等)回收Sc2O3的工艺流程如图。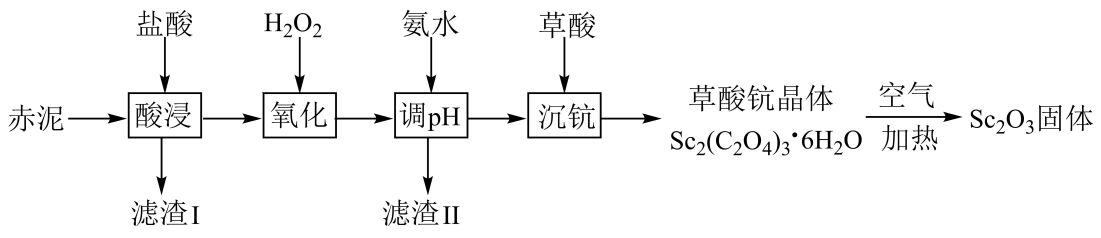
已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
(1)、为提高“酸浸”速率,对“赤泥”的处理方式为;滤渣I的主要成分是(填化学式)。(2)、“氧化”时加入足量H2O2的目的是;氧化后溶液中Fe3+浓度为0.001mol•L-1 , 常温下“调pH”时,若控制pH=3,则Fe3+的去除率为(忽略调pH前后溶液的体积变化)。(3)、已知25℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4Sc2(C2O4)3↓+6H+ , 该反应的平衡常数K=(用含a、b、c的代数式表示)。(4)、Sc2(C2O4)3·6H2O在空气中加热分解时,随温度变化如图所示。已知:M[Sc2(C2O4)3·6H2O]=462g·mol-1。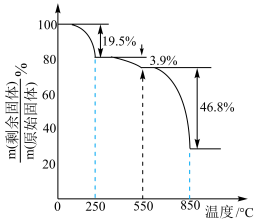
250℃时固体的主要成分是(填化学式);550~850℃时反应的化学方程式为。
18. 四氮化四硫(S4N4 , S为+2价)是重要的硫-氮二元化合物,室温下为橙黄色固体,难溶于水,能溶于CCl4等有机溶剂,可用NH3与SCl2(红棕色液体)反应制备,反应装置如图所示(夹持装置略)。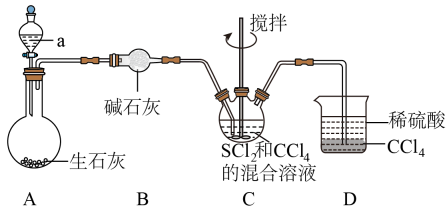
已知:S4N4+6OH-+3H2OS2O+2SO+4NH3↑
回答下列问题:
(1)、试剂a是;装置D的作用是。(2)、装置C中生成S4N4的同时,还生成一种常见固体单质和一种盐,该反应的化学方程式为;证明SCl2反应完全的现象是。(3)、分离产物后测定产品纯度:i.蒸氨:取0.1000g样品加入三颈烧瓶中,再加入足量NaOH溶液并加热蒸出的NH3通入含有V1mLc1mol•L-1H2SO4标准溶液的锥形瓶中。
ii.滴定:用c2mol•L-1溶液滴定剩余的H2SO4 , 消耗V2mLNaOH溶液。
①滴定管的正确操作顺序:检漏→蒸馏水洗涤→(填标号)→开始滴定。
a.装入滴定液至“0”刻度以上
b.调整滴定液液面至“0”刻度
c.排除气泡
d.用滴定液润洗2至3次
e.记录起始读数
②滴定时选用的指示剂为;在接近终点时,放液使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落, , 继续摇动锥形瓶,观察溶液颜色变化。
③S4N4的纯度表达式为;若所用NaOH溶液实际浓度偏低,测定结果(填“偏高”“偏低”或“无影响”)。
19. 布洛芬常用于感冒引起的发热,其一种合成路线如图所示。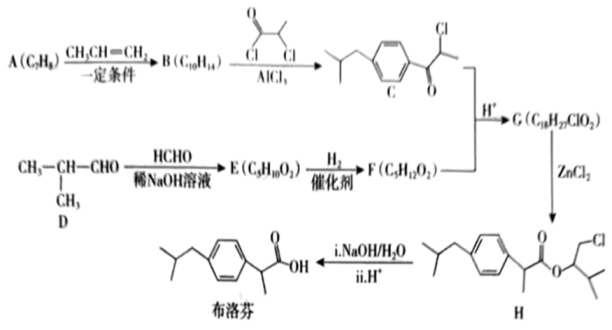
已知:①R-CHO+
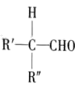
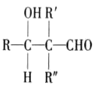
②
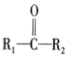 +
+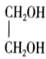
 +H2O
+H2O回答下列问题:
(1)、A的名称为;B→C的反应类型为;E中含氧官能团的名称为。(2)、G的结构简式为;H与足量热的NaOH溶液反应的化学方程式为。(3)、满足下列条件的布洛芬的同分异构体的结构简式为(任写一种)。①能发生银镜反应和水解反应,水解产物遇FeCl3溶液显色;
②苯环上有三个取代基,且苯环上的一氯代物只有两种;
③核磁共振氢谱有5组峰,且峰面积之比为12:2:2:1:1。
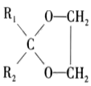
(4)、季戊四醇(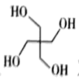 )是一种重要的化工原料,设计由甲醛和乙醇为起始原料制备季戊四醇的合成路线(无机试剂任选)。 20. 以CO2、H2为原料合成CH3OH的反应是研究热点之一,该反应体系涉及的反应如下:
)是一种重要的化工原料,设计由甲醛和乙醇为起始原料制备季戊四醇的合成路线(无机试剂任选)。 20. 以CO2、H2为原料合成CH3OH的反应是研究热点之一,该反应体系涉及的反应如下:I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49kJ•mol-1
II.CO2(g)+H2(g) CO(g)+H2O(g) △H2
回答下列问题:
(1)、已知25℃和101kPa下,H2(g)、CO(g)的燃烧热分别为285.8kJ•mol-1、283.0kJ•mol-1 , H2O(l)=H2O(g)△H=+44kJ•mol-1 , 则△H2=kJ•mol-1。(2)、在恒压密闭容器中,按照n(CO2):n(H2)=1:3投料进行反应,反应Ⅰ、Ⅱ以物质的分压表示的平衡常数Kp随温度T的变化关系如图1所示(体系总压为10kPa)。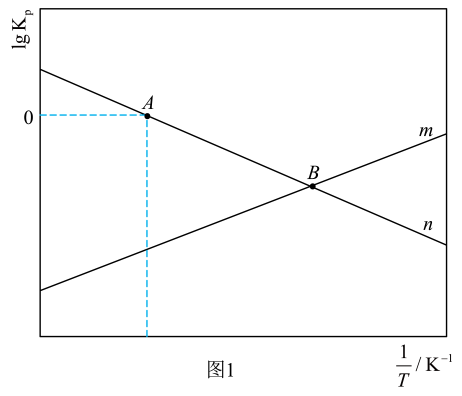
①反应Ⅱ对应图1中(填“m”或“n”);A点对应温度下体系达到平衡时CO2的转化率为80%,反应Ⅰ的Kp=kPa-2(保留两位有效数字)。
②通过调整温度可调控平衡时的值。B点对应温度下,平衡时=400,则p(H2)= kPa。
(3)、在密闭容器中,保持投料比不变,将CO2和H2按一定流速通过反应器,一段时间后,测得CO2转化率(α)和甲醇选择性[x(CH3OH)=×100%]随温度(T)变化关系如图2所示。若233~250℃时催化剂的活性受温度影响不大,则236℃后图中曲线下降的原因是;若气体流速过大,CO2的转化率会降低,原因是。 (4)、向恒温恒压的两个密闭容器甲(T℃、P1)、乙(T℃、P2)中,分别充入物质的量均为amol的CO2和H2 , 若只发生反应Ⅱ,其正反应速率正=k正p(CO2)p(H2),p为气体分压。若甲、乙容器平衡时正反应速率之比甲:乙=16:25,则甲、乙容器的体积之比为。
(4)、向恒温恒压的两个密闭容器甲(T℃、P1)、乙(T℃、P2)中,分别充入物质的量均为amol的CO2和H2 , 若只发生反应Ⅱ,其正反应速率正=k正p(CO2)p(H2),p为气体分压。若甲、乙容器平衡时正反应速率之比甲:乙=16:25,则甲、乙容器的体积之比为。