广东省佛山市禅城区2022-2023学年高三统一调研测试(一) 化学试题
试卷更新日期:2023-03-08 类型:高考模拟
一、单选题
-
1. 《医学入门》中记载我国传统中医提纯铜绿的方法:“水洗净,细研水飞,去石澄清,慢火熬干,”其中未涉及的操作是( )A、洗涤 B、粉碎 C、萃取 D、蒸发2. 化学与生产、生活、科技、医药等密切相关。下列说法错误的是A、冬奥会使用的二氧化碳跨临界制冰技术,与传统制冷剂氟利昂相比更加环保 B、新冠疫苗使用的中硼硅玻璃瓶含有的是一种复杂的氧化物 C、“天宫二号”空间站的太阳能电池帆板,其主要材料含有晶体硅 D、C919国产大飞机风挡结构部分使用的有机玻璃属于有机高分子材料3. 下列化学用语描述或图示表达正确的是( )A、原子结构示意图
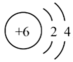 , 可以表示和
B、中子数为127的碘原子:
C、过氧化氢的比例模型:
, 可以表示和
B、中子数为127的碘原子:
C、过氧化氢的比例模型: D、NaClO的电子式:
D、NaClO的电子式: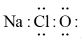 4. 图为酸雨形成的示意图。下列说法正确的是( )
4. 图为酸雨形成的示意图。下列说法正确的是( )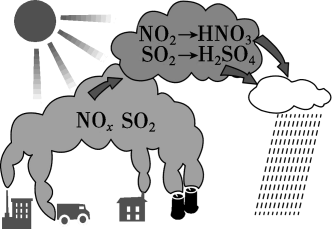 A、空气中的溶于水也会形成酸雨 B、易溶于水,并在雨水中转化为 C、含的雨水在空气中放置其pH可能会降低 D、硝酸型酸雨会腐蚀石灰岩建筑,而硫酸型酸雨不能5. 某无色透明溶液中加入后,有无色无味气体产生,同时产生沉淀。则原溶液中可能含有的离子是( )A、 B、 C、 D、6. 实验室用氯化铵和氢氧化钙反应制取氨气,按照制备、收集、性质检验及尾气处理的顺序进行实验,下列装置(“→”表示气流方向)不能达到实验目的的是A、
A、空气中的溶于水也会形成酸雨 B、易溶于水,并在雨水中转化为 C、含的雨水在空气中放置其pH可能会降低 D、硝酸型酸雨会腐蚀石灰岩建筑,而硫酸型酸雨不能5. 某无色透明溶液中加入后,有无色无味气体产生,同时产生沉淀。则原溶液中可能含有的离子是( )A、 B、 C、 D、6. 实验室用氯化铵和氢氧化钙反应制取氨气,按照制备、收集、性质检验及尾气处理的顺序进行实验,下列装置(“→”表示气流方向)不能达到实验目的的是A、 B、
B、 C、
C、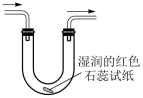 D、
D、 7. 几种物质的转化关系如图所示。下列说法正确的是( )
7. 几种物质的转化关系如图所示。下列说法正确的是( )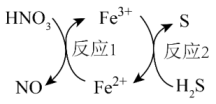 A、反应1中是还原产物 B、反应2中得电子 C、反应2的离子方程式为 D、能和大量共存8. 某药物的一种成分均由短周期主族元素组成,其结构如图所示。元素X、Y、Z、W、E的原子序数依次增大,X与其它几种元素不同周期,W与E原子的基态价电子排布均为。下列说法中错误的是
A、反应1中是还原产物 B、反应2中得电子 C、反应2的离子方程式为 D、能和大量共存8. 某药物的一种成分均由短周期主族元素组成,其结构如图所示。元素X、Y、Z、W、E的原子序数依次增大,X与其它几种元素不同周期,W与E原子的基态价电子排布均为。下列说法中错误的是 A、原子半径:W<E B、最简单氢化物的沸点:Z>Y C、第一电离能:Z>W D、最高价氧化物对应的水化物的酸性:E>Y9. 化学创造美好生活。下列生产活动中,没有运用相应化学原理的是
A、原子半径:W<E B、最简单氢化物的沸点:Z>Y C、第一电离能:Z>W D、最高价氧化物对应的水化物的酸性:E>Y9. 化学创造美好生活。下列生产活动中,没有运用相应化学原理的是选项
生产活动
化学原理
A
环保工程师用熟石灰处理酸性废水
熟石灰具有碱性
B
利用便携式电池为手机提供能量
原电池将化学能转化为电能
C
利用黄铁矿制备硫酸
黄铁矿中硫元素可被氧化
D
利用焦炭和石英砂制取粗硅
二氧化硅具有很好的光学性能
A、A B、B C、C D、D10. 用如图装置进行实验前将液体A逐滴加入到固体B中,下列叙述正确的是( )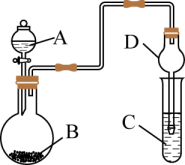 A、若A为浓盐酸,B为 , C为溶液,可证明酸性: B、若A为70%的硫酸,B为固体,C为溶液,则C中溶液变浑浊 C、若A为浓盐酸,B为 , C为石蕊试液,则C中溶液最终呈红色 D、装置D起干燥气体作用11. 饱和氯化钠溶液中存在如图所示过程,下列说法正确的是( )
A、若A为浓盐酸,B为 , C为溶液,可证明酸性: B、若A为70%的硫酸,B为固体,C为溶液,则C中溶液变浑浊 C、若A为浓盐酸,B为 , C为石蕊试液,则C中溶液最终呈红色 D、装置D起干燥气体作用11. 饱和氯化钠溶液中存在如图所示过程,下列说法正确的是( ) A、a离子为Cl- , b离子为Na+ B、此过程中溶解速率小于结晶速率 C、再加入NaCl固体,溶质微粒浓度变大 D、此过程可以说明NaCl的电离: NaCl Na+ +Cl-12. 有关乙醇
A、a离子为Cl- , b离子为Na+ B、此过程中溶解速率小于结晶速率 C、再加入NaCl固体,溶质微粒浓度变大 D、此过程可以说明NaCl的电离: NaCl Na+ +Cl-12. 有关乙醇 说法正确的是( ) A、与钠反应产生H2 , 说明乙醇属于酸 B、分子中含有-OH,所以乙醇是碱 C、发生酯化反应,断裂②键 D、发生氧化反应生成乙醛,断裂①、③键13. 下图是试剂标签上的部分内容。据此,下列说法错误的是
说法正确的是( ) A、与钠反应产生H2 , 说明乙醇属于酸 B、分子中含有-OH,所以乙醇是碱 C、发生酯化反应,断裂②键 D、发生氧化反应生成乙醛,断裂①、③键13. 下图是试剂标签上的部分内容。据此,下列说法错误的是硫酸 化学纯 CP500mL
品名:硫酸化学式:
相对分子质量:98
密度:
质量分数:98%
A、该硫酸物质的量浓度为 B、100mL该硫酸中,氧原子的数目大于7.36NA C、取100mL该硫酸与足量铜反应,产生的分子数小于0.92NA D、将该硫酸稀释至 , 溶液中的数目为0.1 NA14. 下列离子方程式书写正确的是( )A、往KBr溶液中通入少量: B、少量金属钠投入溶液中: C、氢氧化钡溶液与稀硫酸混合: D、铁片投入稀硫酸中:15. 下列由相关实验现象所得出的结论中,正确的是A、能使湿润的淀粉KI试纸变蓝的物质一定是 B、滴加硝酸酸化的溶液后有白色沉淀生成,说明溶液中一定含有 C、Zn粒分别放入稀盐酸和稀硝酸均产生气泡,说明Zn与两种酸均发生置换反应 D、向溶液中先加氯水,再滴加KSCN溶液,溶液显红色,不能说明溶液一定含16. 已知:MnO2+2NaBr+2H2SO4MnSO4+Na2SO4+Br2↑+2H2O,实验室利用如下图所示的装置制备溴苯。下列说法正确的是 A、装置接口按气流方向连接顺序为:d→a→b→f→e→c B、装置甲中进行水浴加热的目的是防止溴蒸气冷凝 C、装置乙中有淡黄色沉淀产生,可证明苯与溴发生了取代反应 D、可用乙醇作洗涤剂除去溴苯中溶解的少量Br2
A、装置接口按气流方向连接顺序为:d→a→b→f→e→c B、装置甲中进行水浴加热的目的是防止溴蒸气冷凝 C、装置乙中有淡黄色沉淀产生,可证明苯与溴发生了取代反应 D、可用乙醇作洗涤剂除去溴苯中溶解的少量Br2二、综合题
-
17. 一种利用黄铁矿烧渣和硫酸铵废液制备铵铁蓝颜料的工艺如下:
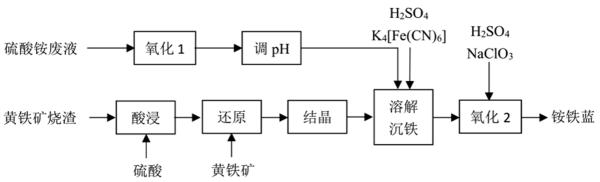
已知:黄铁矿的主要成分是FeS2;铵铁蓝的化学式为 , 难溶于水。
(1)、高纯度硫酸铵溶液能够提高铵铁蓝的品质,为除去硫酸铵废液中的Fe2+和Fe3+ , “氧化1”工序使用酸化的H2O2作为氧化剂,写出反应的离子方程式 , “调pH”工序应加入(写出一种物质的化学式)。(2)、黄铁矿在空气中焙烧得到黄铁矿烧渣,其主要成分是(写化学式)。(3)、“还原”工序获得FeSO4溶液,则“结晶”工序的操作方法是。(4)、“沉铁”工序产生的白色沉淀中Fe的化合价为 , “氧化”工序发生反应的离子方程式为。18. 乙二胺四乙酸(EDTA)及其盐类能与多种金属离子发生络合反应,具有广泛用途。EDTA的分子结构如图所示。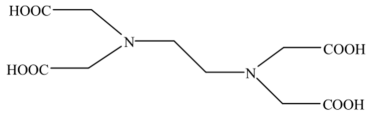 (1)、EDTA所含元素电负性有小到大的顺序为。(2)、EDTA分子中碳原子采取的杂化类型为。基态氧原子核外电子有种运动状态。(3)、EDTA可以与形成盐,分子的VSEPR模型为。氨熔沸点低,铵盐熔沸点高,原因是。(4)、EDTA及其盐可与形成稳定络合物,用于测定水的硬度,这一性质与EDTA分子中原子能够提供孤电子对有关。19. 一氧化二氯(Cl2O)是国际公认的高效安全灭菌消毒剂,其部分性质如下:现用如图所示装置制备少量Cl2O。
(1)、EDTA所含元素电负性有小到大的顺序为。(2)、EDTA分子中碳原子采取的杂化类型为。基态氧原子核外电子有种运动状态。(3)、EDTA可以与形成盐,分子的VSEPR模型为。氨熔沸点低,铵盐熔沸点高,原因是。(4)、EDTA及其盐可与形成稳定络合物,用于测定水的硬度,这一性质与EDTA分子中原子能够提供孤电子对有关。19. 一氧化二氯(Cl2O)是国际公认的高效安全灭菌消毒剂,其部分性质如下:现用如图所示装置制备少量Cl2O。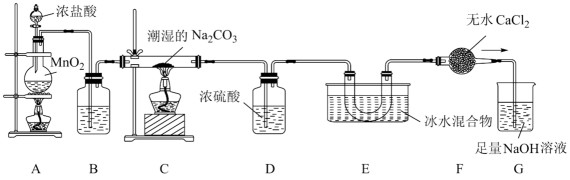
已知:常温下,Cl2O是棕黄色、有刺激性气味的气体,易溶于水;熔点:-120.6℃;沸点2.0℃。
(1)、盛有浓盐酸的仪器的名称是。(2)、装置A中发生反应的离子方程式为。(3)、装置B中的试剂是。(4)、装置C中固体产物为NaCl和 , 写出该反应的化学方程式。(5)、装置E中Cl2O的收率与装置C的温度和纯碱的含水量的关系如表所示,下列猜想明显不合理的是____。温度/℃
纯碱含水量/%
Cl2O收率/%
0~10
5.44
67.85
0~10
7.88
89.26
10~20
8.00
64.24
30~40
10.25
52.63
30~40
12.50
30.38
A、温度越高,Cl2O的收率越低 B、纯碱含水量越高,Cl2O的收率越高 C、随着纯碱含水量增大,Cl2O的收率先增大后减小 D、温度较低时,纯碱含水量越高,Cl2O的收率越高,温度较高时,纯碱含水量越高,Cl2O的收率越低(6)、C中盛装含水碳酸钠(即与水按照质量106∶9调制而成),用来吸收氯气制备Cl2O。如果用表示含水碳酸钠,则x为。20. 某小组探究乙醛与银氨溶液反应产生银镜的条件。已知:。
(1)、向银氨溶液中滴加乙醛,振荡后将试管放在热水浴中加热,试管内壁产生银镜。写出反应的化学方程式。(2)、文献记载:碱性条件有利于银镜产生。小组设计实验验证该说法。序号
实验
试剂
混合液pH
现象
Ⅰ

NaOH
10
常温产生银镜
Ⅱ
浓氨水
10
加热无银镜
Ⅲ
无
8
加热才能产生银镜
①对比实验和 , 证实了文献的说法。
②实验Ⅱ未产生银镜,结合以下机理简要分析原因。
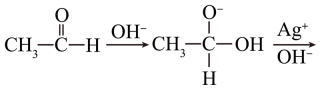 CH3COO-+Ag(3)、文献还记载:在强碱条件下,加热银氨溶液可能析出银镜。小组进一步实验如下。
CH3COO-+Ag(3)、文献还记载:在强碱条件下,加热银氨溶液可能析出银镜。小组进一步实验如下。实验Ⅳ:向银氨溶液中加入NaOH溶液至pH=14,得到棕黑色沉淀,振荡后将试管放在热水浴中温热,有气泡产生,试管内壁产生银镜。
①实验Ⅳ中,将Ag元素还原的离子可能是。
②经检验棕黑色沉淀Y中含有Ag单质,请设计实验方案验证:。
21. 一种合成解热镇痛类药物布洛芬的方法如下:
已知是一种还原剂,回答下列问题。
(1)、C的分子式为。(2)、D的结构简式是。(3)、E→F的化学方程式为。(4)、化合物M的分子式为 , 与布洛芬互为同系物,且有6个化学环境相同的氢原子,写出一种符合条件的M的结构简式。(5)、参照上述合成路线,设计一条以2—丙醇主要原料合成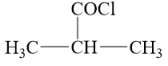 的合成路线(其他无机试剂任选)。
的合成路线(其他无机试剂任选)。