辽宁省沈阳市2023届高三教学质量检测(一模)化学试题
试卷更新日期:2023-03-08 类型:高考模拟
一、单选题
-
1. 辽宁省的历史源远流长,有着独具特色的文化积淀。下列说法中正确的是A、锦州的满族刺绣以家织布为底衬,制作家织布的棉花属于再生纤维 B、藏于辽宁省博物馆的洛神赋图,所用纸张的主要成分属于高级脂肪酸甘油酯 C、阜新被称为“世界玛瑙之都”,玛瑙的主要成分是二氧化硅 D、沈阳老龙口白酒酿造过程中,将淀粉直接转化为乙醇2. 下列化学用语使用正确的是( )A、氯气的共价键电子云轮廓图:
 B、基态的价层电子排布图:
B、基态的价层电子排布图: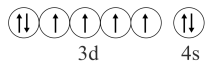 C、用电子式表示的形成过程:
C、用电子式表示的形成过程: D、的空间填充模型:
D、的空间填充模型: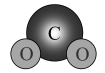 3. 下列说法中正确的是A、海水中富集元素常用作为沉淀剂 B、标准状况下,溶于水可得分子 C、78克与足量水完全反应,转移电子 D、盐酸标准液标定未知浓度溶液时,酸式滴定管水洗后未润洗会使测定结果偏低4. 2022年的诺贝尔化学奖颁给了K.Barry Sharpless等三位化学家,以表彰他们对“点击化学”发展做出的贡献。如图为点击化学的经典反应机理。下列说法中正确的是
3. 下列说法中正确的是A、海水中富集元素常用作为沉淀剂 B、标准状况下,溶于水可得分子 C、78克与足量水完全反应,转移电子 D、盐酸标准液标定未知浓度溶液时,酸式滴定管水洗后未润洗会使测定结果偏低4. 2022年的诺贝尔化学奖颁给了K.Barry Sharpless等三位化学家,以表彰他们对“点击化学”发展做出的贡献。如图为点击化学的经典反应机理。下列说法中正确的是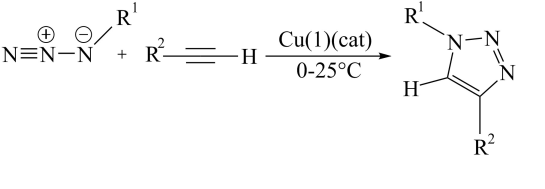 (和都是烷基)A、化合物C可发生加成反应 B、化合物B所有原子都在同一条直线上 C、反应中碳原子的杂化方式有2种 D、A,B,C的所有原子均满足8电子结构5. 已知:可由与过量的溶液反应生成。类推是常用的思维方法,下列类推中正确的是A、属于酸式盐,也属于酸式盐 B、是酸性氧化物,也是酸性氧化物 C、15-冠-5(冠醚)能识别 , 则12-冠-4(冠醚)也能识别 D、与水反应生成碱,与水反应也生成碱6. 如图所示的有机化合物是核酸病毒保存液的重要成分之一。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Y同周期,Z的价电子数等于X的原子序数。下列说法中正确的是
(和都是烷基)A、化合物C可发生加成反应 B、化合物B所有原子都在同一条直线上 C、反应中碳原子的杂化方式有2种 D、A,B,C的所有原子均满足8电子结构5. 已知:可由与过量的溶液反应生成。类推是常用的思维方法,下列类推中正确的是A、属于酸式盐,也属于酸式盐 B、是酸性氧化物,也是酸性氧化物 C、15-冠-5(冠醚)能识别 , 则12-冠-4(冠醚)也能识别 D、与水反应生成碱,与水反应也生成碱6. 如图所示的有机化合物是核酸病毒保存液的重要成分之一。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Y同周期,Z的价电子数等于X的原子序数。下列说法中正确的是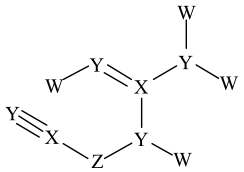 A、第一电离能:X>Y B、W、Y、Z可形成离子化合物 C、分子中可能所有原子均共面 D、X、Y、Z的简单氢化物在水中均是强酸7. 近日北京大学肿瘤医院发现,天然小分子白皮杉醇在胃癌治疗中有重要应用价值。其结构如图所示,下列有关白皮杉醇的说法正确的是
A、第一电离能:X>Y B、W、Y、Z可形成离子化合物 C、分子中可能所有原子均共面 D、X、Y、Z的简单氢化物在水中均是强酸7. 近日北京大学肿瘤医院发现,天然小分子白皮杉醇在胃癌治疗中有重要应用价值。其结构如图所示,下列有关白皮杉醇的说法正确的是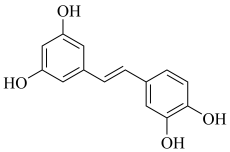 A、不能使酸性溶液褪色 B、苯环上氢原子的一氯代物有4种 C、白皮杉醇最多能与发生反应 D、白皮杉醇最多能与发生加成反应8. 明代《徐光启手迹》记载了制备王水的方法,其主要流程如图所示(水蒸气等部分产物已省略),下列说法中正确的是
A、不能使酸性溶液褪色 B、苯环上氢原子的一氯代物有4种 C、白皮杉醇最多能与发生反应 D、白皮杉醇最多能与发生加成反应8. 明代《徐光启手迹》记载了制备王水的方法,其主要流程如图所示(水蒸气等部分产物已省略),下列说法中正确的是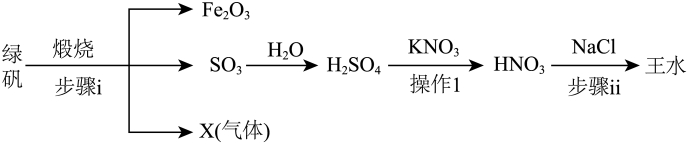 A、X不能使酸性溶液褪色 B、操作1的名称为蒸馏 C、流程中涉及的均为非氧化还原反应 D、步骤ⅱ能在铁容器中进行9. 下列实验方案及实验现象都正确的是
A、X不能使酸性溶液褪色 B、操作1的名称为蒸馏 C、流程中涉及的均为非氧化还原反应 D、步骤ⅱ能在铁容器中进行9. 下列实验方案及实验现象都正确的是选项
实验目的
实验操作及实验现象
A
鉴别白色粉末状晶体的尿素和氯化铵
分别取少量晶体于试管中,加入足量浓溶液加热,在试管口放置湿润的红色石蕊试纸,只有一支试管口试纸变蓝
B
检验铁锈中是否含有二价铁
将铁锈溶于浓盐酸,滴入溶液紫色褪去
C
探究浓度对、相互转化的影响
取少量溶液于试管中,向其中滴加一定量硫酸,溶液黄色变为橙红色;再滴加一定量溶液,溶液又变为黄色
D
鉴别红棕色气体是溴蒸气
用湿润的淀粉试纸检验,试纸变蓝色
A、A B、B C、C D、D10. 某温度下,恒容密闭容器内加入等物质的量和发生反应 , , k为速率常数。反应一段时间后达到平衡。下列说法中错误的是A、若 , 则该反应 B、加入一定量 , 混合气体颜色变深 C、加入一定量氩气,容器内压强增大,反应速率不变 D、加入等物质的量的和 , 转化率不变11. 西安交通大学和上海大学利用冷冻透射电子显微镜,在石墨烯膜上直接观察到了自然环境下生长的由钙元素和氯元素构成的二维晶体,其结构如图。下列说法中错误的是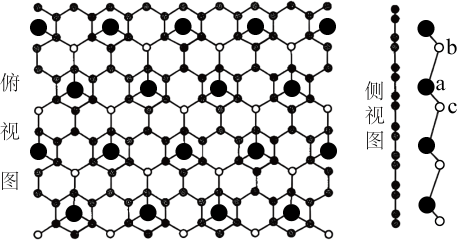 A、该二维晶体的化学式为 B、石墨烯C原子与键数之比为 C、图中a离子分别与b、c离子的距离不相等 D、该晶体的形成可能与钙离子和石墨间存在强的阳离子相互作用有关12. 电子科技大学和德国明斯特大学共同研发一种用于可充电空气电池的低成本非碱性醋酸锌[简写为]电解质,与传统的碱性相比,具有优异的循环性能和在空气中的稳定性,放电时最终产物是 , 工作原理如图。下列说法正确的是
A、该二维晶体的化学式为 B、石墨烯C原子与键数之比为 C、图中a离子分别与b、c离子的距离不相等 D、该晶体的形成可能与钙离子和石墨间存在强的阳离子相互作用有关12. 电子科技大学和德国明斯特大学共同研发一种用于可充电空气电池的低成本非碱性醋酸锌[简写为]电解质,与传统的碱性相比,具有优异的循环性能和在空气中的稳定性,放电时最终产物是 , 工作原理如图。下列说法正确的是 A、放电时电子通过导线移向甲电极 B、若使用碱性电解质,会造成负极锌的不可逆转化,影响充电效果 C、放电时,每转移 , 理论上会产生 D、充电时,向电极甲移动13. 已知硫的两种晶体形态的相图如图所示(相图:用于描述不同温度、压强下硫单质的转化及存在状态的平衡图像),燃烧的热化学方程式为:
A、放电时电子通过导线移向甲电极 B、若使用碱性电解质,会造成负极锌的不可逆转化,影响充电效果 C、放电时,每转移 , 理论上会产生 D、充电时,向电极甲移动13. 已知硫的两种晶体形态的相图如图所示(相图:用于描述不同温度、压强下硫单质的转化及存在状态的平衡图像),燃烧的热化学方程式为:S(斜方,s) ;
S(单斜,s) 。
则下列有关说法中正确的是
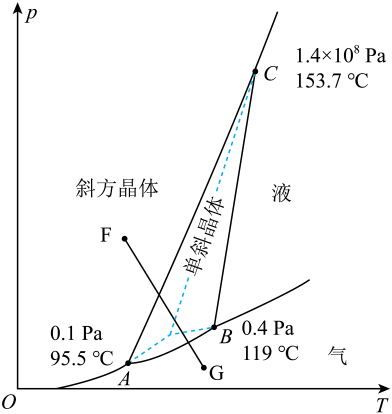 A、温度高于119℃且压强小于 , 单斜硫发生液化现象 B、斜方硫和单斜硫互为同分异构体 C、图中F→G过程为固态硫的气化,该过程只破坏了分子间作用力 D、由上述信息可判断:14. 在催化剂作用下,分解生成和可能的反应机理如图所示。研究发现:其他条件不变时,向溶液添加催化释氢的效果更佳。下列说法中错误的是
A、温度高于119℃且压强小于 , 单斜硫发生液化现象 B、斜方硫和单斜硫互为同分异构体 C、图中F→G过程为固态硫的气化,该过程只破坏了分子间作用力 D、由上述信息可判断:14. 在催化剂作用下,分解生成和可能的反应机理如图所示。研究发现:其他条件不变时,向溶液添加催化释氢的效果更佳。下列说法中错误的是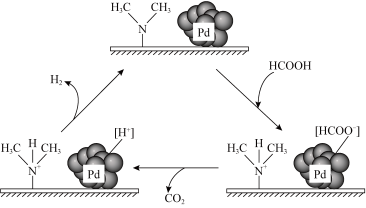 A、催化释氢反应除生成外,还生成 B、添加的溶液催化释氢产物是、和 C、添加后可以使反应加速 D、该过程中有配位键的形成和断裂15. 赖氨酸[ , 用表示]是人体必需氨基酸,其盐酸盐在水溶液中存在如下平衡:。向一定浓度的溶液中滴加溶液,溶液中、、和的分布系数随变化如图所示。已知 , 下列表述中正确的是
A、催化释氢反应除生成外,还生成 B、添加的溶液催化释氢产物是、和 C、添加后可以使反应加速 D、该过程中有配位键的形成和断裂15. 赖氨酸[ , 用表示]是人体必需氨基酸,其盐酸盐在水溶液中存在如下平衡:。向一定浓度的溶液中滴加溶液,溶液中、、和的分布系数随变化如图所示。已知 , 下列表述中正确的是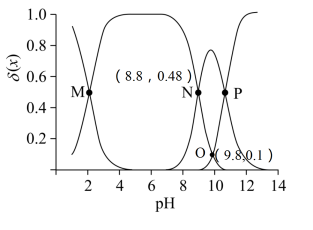 A、 B、M点, C、O点, D、P点,
A、 B、M点, C、O点, D、P点,二、综合题
-
16. 铟被广泛应用于电子工业、航空航天、太阳能电池新材料、合金制造等高科技领域。自然界铟大多富集在闪锌矿(主要成分 , 还含有、等杂质)中,工业上常采用铅锌冶炼过程中的含铟烟灰作为回收铟的主要原料。如图为工业提取铟的流程图:
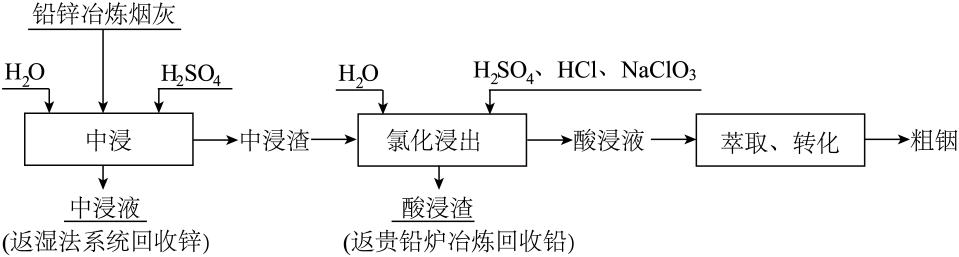
已知:①烟灰中钢主要以硫化铟、氧化铟以及和形式存在,其中和的化学性质非常稳定,难以被硫酸溶解浸出。
②铅锌冶炼烟灰先经稀硫酸溶液预处理后得到中浸渣,主要成分如下:
成分
质量分数(%)
0.72
3.01
60.48
8.92
1.16
③酸性条件下,温度过高,氯酸钠易分解释放出氯气。
回答下列问题:
(1)、铟元素位于元素周期表第周期族。(2)、闪锌矿经氧化焙烧可获得铅锌烟灰,焙烧时气体与矿料逆流而行,目的是。(3)、写出闪锌矿主要成分氧化焙烧反应的化学方程式。(4)、已知与发生反应生成配合离子 , 不利于的萃取,则“氯化浸出”实验中加入硫酸的原因是。(5)、氯化步骤中,铟元素被氧化到最高正价,写出氯化过程中发生反应的离子方程式(产物中元素以形式存在)。在氯化过程中,反应温度、时长、盐酸、硫酸、氯酸钠的浓度都会影响铟元素的浸出率,控制其他条件不变,考查不同浸出温度对铟浸出率的影响,结果如图所示。实验采取的是80℃的条件,原因是。 (6)、转化步骤中往往需要加入“锌粉”,其作用是。17. 氢气作为一种清洁能源,一直是能源研究的热点,水煤气变换反应可用于大规模制 , 反应原理如下:(1)、根据下表中提供的数据,计算。
(6)、转化步骤中往往需要加入“锌粉”,其作用是。17. 氢气作为一种清洁能源,一直是能源研究的热点,水煤气变换反应可用于大规模制 , 反应原理如下:(1)、根据下表中提供的数据,计算。化学键
键能
803
x
463
436
(2)、实验发现其他条件不变,在体系中投入一定量可以增大的体积分数,从化学平衡的角度解释原因。(3)、某温度下,在一恒容密闭容器中充入和 , 加入催化剂使其发生上述反应(忽略其他副反应),测得该反应中初始压强为 , 分压如图甲所示(t时刻前,的分压未给出),则A点坐标为(t,)、平衡常数。 (4)、反应的Arrhenius经验公式的实验数据如图乙中曲线所示,已知经验公式为(其中为活化能,k为速率常数,R和C为常数)。该反应的活化能。当使用更高效催化剂时,请绘制关系示意图。(假定实验条件下,催化剂对C值无影响)
(4)、反应的Arrhenius经验公式的实验数据如图乙中曲线所示,已知经验公式为(其中为活化能,k为速率常数,R和C为常数)。该反应的活化能。当使用更高效催化剂时,请绘制关系示意图。(假定实验条件下,催化剂对C值无影响)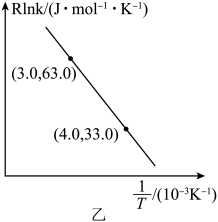 (5)、储氢合金能有效解决氢气的贮存和运输问题。某储氢合金的结构属六方晶系,晶体结构及俯视图分别如图(a)、(b)所示。已知a、b两点的分数坐标分别为、 , 则c点坐标为。X射线衍射测定两晶面间距为(见图b),高为 , 设阿伏加德罗常数的值为 , 该晶体的摩尔质量为 , 则密度为。(列出表达式)
(5)、储氢合金能有效解决氢气的贮存和运输问题。某储氢合金的结构属六方晶系,晶体结构及俯视图分别如图(a)、(b)所示。已知a、b两点的分数坐标分别为、 , 则c点坐标为。X射线衍射测定两晶面间距为(见图b),高为 , 设阿伏加德罗常数的值为 , 该晶体的摩尔质量为 , 则密度为。(列出表达式)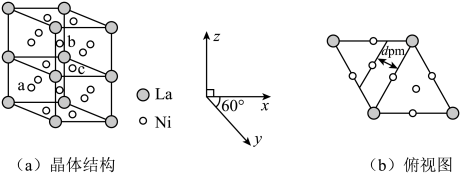 18. 在染色和催化领域应用广泛,某研究小组欲利用如图装置(加热和夹持装置略去)将二氧化硫通入新制氢氧化铜悬浊液中制备。
18. 在染色和催化领域应用广泛,某研究小组欲利用如图装置(加热和夹持装置略去)将二氧化硫通入新制氢氧化铜悬浊液中制备。
已知:为白色固体,难溶于水和乙醇,能溶于浓盐酸。
实验步骤及现象:
①向C中先加入溶液,再加入溶液;
②打开A中分液漏斗的活塞产生气体至过量,刚开始C中出现少量淡黄色固体,静置一会儿之后,底部有较多的白色沉淀,上层是淡绿色的溶液。
③将C中混合物过滤、依次用水和乙醇洗涤、烘干,所得固体质量为。
回答下列问题:
(1)、试剂a为浓硫酸,b仪器的名称为。(2)、装置B中长颈漏斗的作用是。(3)、将通入C中,与新制氢氧化铜悬浊液反应,产生白色固体的离子方程式为。(4)、小组成员针对步骤2中的现象展开进一步的探究得出:ⅰ.白色沉淀为。
ⅱ.上层淡绿色溶液中的主要溶质为和少量。
结论:本实验中较多量的新制氢氧化铜与二氧化硫发生了氧化还原反应,少量与之发生了复分解反应,二者为竞争关系。试分析主要发生氧化还原反应的原因。
(5)、用乙醇洗涤的优点为。(6)、计算该实验中的产率为%。(7)、已知: , , 。若所得固体中混有少量 , 请补充完除去的实验方案:①向产物中滴加试剂 , 使固体充分溶解,再过滤出杂质;
②向滤液中加水稀释至不再产生沉淀为止;
③过滤、洗涤、干燥,可得到除去后的固体。
19. 布洛芬具有抗炎、止痛、解热的作用。其合成路线如图所示: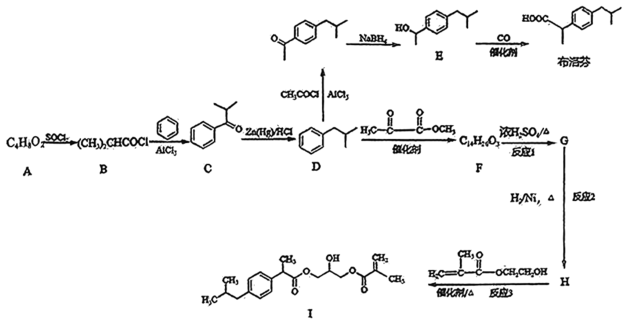
已知:
 , 回答下列问题:(1)、A的名称是。(2)、C→D的反应类型为。(3)、写出D→F的反应方程式。(4)、D→I的过程,即为布洛芬结构修饰的过程,中间产物H的结构简式为。(5)、I进行加聚反应即可得到缓释布洛芬,反应的官能团名称是。(6)、满足以下条件的布洛芬的同分异构体有种。
, 回答下列问题:(1)、A的名称是。(2)、C→D的反应类型为。(3)、写出D→F的反应方程式。(4)、D→I的过程,即为布洛芬结构修饰的过程,中间产物H的结构简式为。(5)、I进行加聚反应即可得到缓释布洛芬,反应的官能团名称是。(6)、满足以下条件的布洛芬的同分异构体有种。A.含苯环,核磁共振氢谱有5组峰
B.能发生水解反应,且水解产物之一能与溶液发生显色反应
C.能发生银镜反应
(7)、下列有关布洛芬的说法正确的是____。A、布洛芬属于羧酸,故与乙酸互为同系物 B、布洛芬分子中含有手性碳原子 C、可以用碳酸氢钠溶液区分布洛芬和酯修饰产物I D、布洛芬分子中最多有19个原子共平面