上海市奉贤区2022-2023学年高三上学期一模练习卷化学试题
试卷更新日期:2023-03-08 类型:高考模拟
一、单选题
-
1. 为了控制疾病,经常会用到各类消毒剂。下列消毒剂的有效成分属于盐的是A、0.3%的高锰酸钾溶液 B、3%的双氧水 C、15%的过氧乙酸溶液 D、75%的医用酒精2. 下列厨房中常用物质的主要成分属于强电解质的是A、醋酸 B、自来水 C、小苏打 D、淀粉3. 钛合金具有熔点高、密度小、易于加工和良好的“生物相容性”。其用途不合理的是A、制造电流保险丝 B、制造眼镜架 C、制造“人造关节” D、制造飞机机身4. 2022年科学家合成了钠的同位素-39Na。下列关于39Na说法正确的是A、质子数为28 B、电子数为39 C、质量数为50 D、与23Na化学性质基本相同5. 下列化学用语表示正确的是A、乙炔结构式:HC≡CH B、氢氧化钾电子式:
 C、氧离子核外电子排布式:1s22s22p4
D、聚丙烯链节:-CH2-CH2-CH2-
6. 下列物质的化学式中阴阳离子的个数比不是1:1的是A、NaHCO3 B、NaOH C、Na2O2 D、CaO27. 下列关于氮及其化合物的说法错误的是A、自然固氮、人工固氮都是将N2转化为NH3 B、以H2O、NH3、CO2、NaCl为原料制备NaHCO3是侯氏制碱法的重要过程 C、工业上通过NH3催化氧化等反应可生产HNO3 D、自然界中的“氮循环”是氮及其化合物间相互转化的一种途径8. 下列转化不可能通过一步反应直接完成的是( )A、Al→Al2O3 B、Al2O3→Al(OH)3 C、Al(OH)3→AlO D、Al3+→Al(OH)39. 下列实验操作与物质的溶解性无关的是A、用水洗气,能除去混在CO中的HCl B、用CCl4能萃取碘水中的碘单质 C、蒸馏海水,能得到淡水 D、冷却KNO3饱和溶液,能耗析出KNO3晶体10. 关于CH2=CH-CH=CH2的说法错误的是A、与2-丁炔互为同分异构体 B、是乙烯的同系物 C、可使酸性高锰酸钾溶液褪色 D、与氢气反应,可能生成三种产物11. 从中药茯苓中提取的茯苓新酸其结构简式如图所示。下列有关茯苓新酸的说法错误的是
C、氧离子核外电子排布式:1s22s22p4
D、聚丙烯链节:-CH2-CH2-CH2-
6. 下列物质的化学式中阴阳离子的个数比不是1:1的是A、NaHCO3 B、NaOH C、Na2O2 D、CaO27. 下列关于氮及其化合物的说法错误的是A、自然固氮、人工固氮都是将N2转化为NH3 B、以H2O、NH3、CO2、NaCl为原料制备NaHCO3是侯氏制碱法的重要过程 C、工业上通过NH3催化氧化等反应可生产HNO3 D、自然界中的“氮循环”是氮及其化合物间相互转化的一种途径8. 下列转化不可能通过一步反应直接完成的是( )A、Al→Al2O3 B、Al2O3→Al(OH)3 C、Al(OH)3→AlO D、Al3+→Al(OH)39. 下列实验操作与物质的溶解性无关的是A、用水洗气,能除去混在CO中的HCl B、用CCl4能萃取碘水中的碘单质 C、蒸馏海水,能得到淡水 D、冷却KNO3饱和溶液,能耗析出KNO3晶体10. 关于CH2=CH-CH=CH2的说法错误的是A、与2-丁炔互为同分异构体 B、是乙烯的同系物 C、可使酸性高锰酸钾溶液褪色 D、与氢气反应,可能生成三种产物11. 从中药茯苓中提取的茯苓新酸其结构简式如图所示。下列有关茯苓新酸的说法错误的是 A、可使酸性KMnO4溶液褪色 B、可与金属钠反应产生H2 C、分子中含有3种官能团 D、可发生取代反应和加成反应12. 常温下,在pH=1的无色溶液中,能大量共存的一组离子是A、K+、Na+、SO、Br- B、Na+、K+、ClO-、NO C、K+、Cl-、Fe3+、SO D、Al3+、Na+、Cl-、NO13. 下列有关物质检验的实验结论正确的是
A、可使酸性KMnO4溶液褪色 B、可与金属钠反应产生H2 C、分子中含有3种官能团 D、可发生取代反应和加成反应12. 常温下,在pH=1的无色溶液中,能大量共存的一组离子是A、K+、Na+、SO、Br- B、Na+、K+、ClO-、NO C、K+、Cl-、Fe3+、SO D、Al3+、Na+、Cl-、NO13. 下列有关物质检验的实验结论正确的是选项
实验操作及现象
实验结论
A
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
该溶液中一定含有
B
向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色
该溶液中一定含有
C
将某气体通入品红溶液中,品红溶液褪色
该气体一定为
D
将少量有机物滴加到新制氢氧化铜溶液中,充分振荡,未见红色沉淀生成
该有机物不含醛基
A、A B、B C、C D、D14. 类推是学习化学的一种重要手段,下列类推结论正确的是选项
客观事实
类推结论
A
将铜片加入足量稀硝酸中,铜片会被溶解
将铜片加入足量稀盐酸中,铜片也会被溶解
B
H2S和CuSO4溶液反应有黑色沉淀生成
H2S和CuCl2溶液反应也有黑色沉淀生成
C
向AgNO3溶液中滴加过量NaOH溶液,最终有沉淀生成
向AgNO3溶液中滴加过量的氨水,最终也有沉淀生成
D
将CO2通入Ba(NO3)2溶液中无明显现象
将SO2通入Ba(NO3)2溶液中也无明显现象
A、A B、B C、C D、D15. 我国科学家研发甲烷和二氧化碳的共转化技术制取乙酸。下列说法正确的是A、该反应属于取代反应 B、消耗22.4LCO2可制得乙酸60g C、反应物和生成物中均含极性键和非极性键 D、该反应符合“绿色化学”原理,原子利用率达100%16. 亚硝酰氯(NOCl)在有机合成中有重要应用。2NO(g)+Cl2(g)→2NOCl(g)的反应历程如图。下列说法错误的是 A、相对于曲线Ⅱ,曲线Ⅰ表示加入催化剂 B、催化剂能提高反应物的相对能量 C、反应物总能量高于生成物的总能量 D、2NO(g)+Cl2(g)→2NOCl(g)+77.1kJ17. 利用CO2的氧化性制成的新型固态电池有望成为火星探测器的供电设备。该电池正、负极分别为碳纳米管、金属钠,Na3Zr2Si2PO12固体为电解质,电池放电时A、将电能转化为化学能 B、CO2能在正极上得到电子 C、电子通过Na3Zr2Si2PO12移向正极 D、负极上发生还原反应18. 2022年诺贝尔化学奖授予了点击化学等领域。我国科学家在研究点击反应砌块的过程中,发现了一种结构如图的化合物,X、Y、Z和W是原子序数依次增大的短周期元素,Y和W是同主族元素。下列说法正确的是
A、相对于曲线Ⅱ,曲线Ⅰ表示加入催化剂 B、催化剂能提高反应物的相对能量 C、反应物总能量高于生成物的总能量 D、2NO(g)+Cl2(g)→2NOCl(g)+77.1kJ17. 利用CO2的氧化性制成的新型固态电池有望成为火星探测器的供电设备。该电池正、负极分别为碳纳米管、金属钠,Na3Zr2Si2PO12固体为电解质,电池放电时A、将电能转化为化学能 B、CO2能在正极上得到电子 C、电子通过Na3Zr2Si2PO12移向正极 D、负极上发生还原反应18. 2022年诺贝尔化学奖授予了点击化学等领域。我国科学家在研究点击反应砌块的过程中,发现了一种结构如图的化合物,X、Y、Z和W是原子序数依次增大的短周期元素,Y和W是同主族元素。下列说法正确的是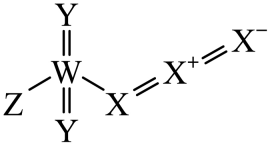 A、简单离子半径:Y<Z B、简单氢化物的沸点:Y<W C、化合物XH4H中的化学键均为共价键 D、Y与X、Y与W均能形成多种化合物19. 常温下用0.1000 mol∙L−1盐酸滴定25mL0.1000 mol∙L−1Na2CO3溶液,溶液pH随加入盐酸体积的变化如图所示。下列说法正确的是
A、简单离子半径:Y<Z B、简单氢化物的沸点:Y<W C、化合物XH4H中的化学键均为共价键 D、Y与X、Y与W均能形成多种化合物19. 常温下用0.1000 mol∙L−1盐酸滴定25mL0.1000 mol∙L−1Na2CO3溶液,溶液pH随加入盐酸体积的变化如图所示。下列说法正确的是 A、a点:c(CO)>c(HCO)>c(Cl-) B、b点:5c(Cl-)>4c(HCO)+4c(CO) C、c点:c(OH-)=c(H+)+c(HCO)+2c(H2CO3) D、d点:c(H+)=c(CO)+c(HCO)+c(OH-)20. 恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g)⇌N2(g)+3H2(g),测得不同起始浓度()和催化剂表面积下氨浓度随时间的变化,如表所示,下列说法错误的是
A、a点:c(CO)>c(HCO)>c(Cl-) B、b点:5c(Cl-)>4c(HCO)+4c(CO) C、c点:c(OH-)=c(H+)+c(HCO)+2c(H2CO3) D、d点:c(H+)=c(CO)+c(HCO)+c(OH-)20. 恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g)⇌N2(g)+3H2(g),测得不同起始浓度()和催化剂表面积下氨浓度随时间的变化,如表所示,下列说法错误的是编号
0
20
40
60
80
①
a
2.40
2.00
1.60
1.20
0.80
②
a
1.20
0.80
0.40
x
③
2a
2.40
1.60
0.80
0.40
0.40
A、实验①,0~20min, B、实验②,60min时处于平衡状态, C、相同条件下,增加氨气的浓度,反应速率增大 D、相同条件下,增加催化剂的表面积,反应速率增大二、非选择题
-
21. 氮、氧、氯及其化合物在生产生活中有广泛的应用。(1)、氧原子核外共有种能量不同的电子,氯原子核外未成对电子所占据的轨道符号是 , NH3分子的空间构型为。(2)、请比较氮、氧元素的非金属性:氮氧(选填“>”或“<”),用一个化学事实进行说明。
已知:①NaNO2具有毒性和强氧化性;②酸性强弱:H2SO3>HNO2>CH3COOH。
(3)、含NaNO2的废水直接排放会引起严重的水体污染,工业上常用还原剂将其转化为无污染的气体,用NH4Cl还原NaNO2的离子方程式为 , 若生成1mol氧化产物,则反应中转移的电子数目是。(4)、向冷NaNO2溶液中加入下列某种物质可得HNO2溶液,该物质可以为。a.二氧化碳 b.二氧化硫 c.醋酸 d.稀硫酸
(5)、常温下将0.02mol·L-1的NaNO2溶液和0.01mol·L-1的盐酸等体积混合,溶液呈酸性,则c(NO)+c(HNO2)0.01mol·L-1 , c(NO)+c(Cl-)0.01mol·L-1(选填“>”、“<”或“=”)。22. 氢燃料电池有良好的应用前景。工业上常用下列方法制取氢气。(1)、Ⅰ.甲烷与水蒸气催化重整制取氢气,主要反应为:CH4(g)+H2O(g)CO(g)+3H2(g)。上述反应体系中属于非极性分子的化合物是。
(2)、一定条件下,向体积为2L的密闭容器中充入1molCH4和1molH2O(g)发生上述反应,10min时反应达到平衡状态,此时CH4的浓度为0.4 mol∙L−1 , 则0~10min内H2的平均反应速率为mol∙L−1∙min−1。(3)、Ⅱ.甲烷与硫化氢催化重整制取氢气,主要反应为:CH4(g)+2H2S(g)CS2(g)+4H2(g)。恒温恒容时,该反应一定处于平衡状态的标志是。
a.υ正(H2S)=2υ逆(H2) b.CH4的体积分数不再变化
c.不再变化 d.混合气体的密度不再改变
(4)、该反应平衡常数表达式K= , 若改变某一条件使平衡向正反应方向移动,则K值。a.一定改变 b.可能增大 c.可能减小 d.可能不变
(5)、III.将原料气按n(CH4):n(H2S)=1:2充入反应容器中,保持体系压强为0.1MPa,研究不同温度对该反应体系的影响。平衡体系中各组分的物质的量分数x随温度T的变化如图所示: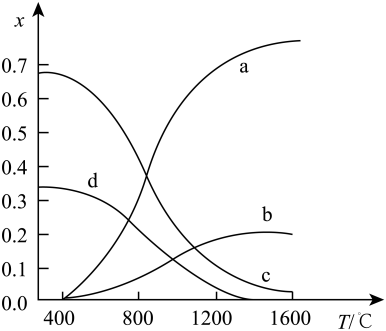
图中表示H2物质的量分数变化的曲线是(选填字母),该反应的正反应为反应(选填“放热”或“吸热”)。保持其他条件不变,升高温度测得CH4的平衡转化率先增大后下降,其原因可能是。
23. 五水合硫代硫酸钠(Na2S2O3﹒5H2O,式量为248)俗称海波、大苏打,可用于纺织、造纸等领域。某学习小组制备Na2S2O3﹒5H2O,并测定产品纯度,实验方案如下。(1)、I.制备Na2S2O3﹒5H2O已知:S+Na2SO3Na2S2O3
按如图所示装置(加热及夹持装置省略)进行实验,再经多步操作制得Na2S2O3﹒5H2O的粗产品

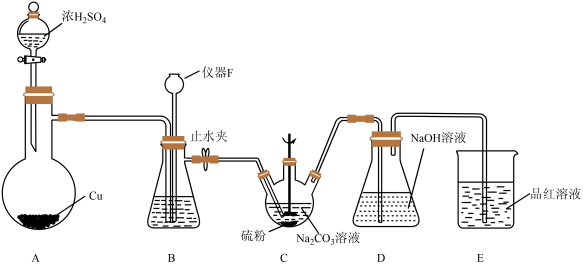
仪器F的名称为 , 装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(2)、用离子方程式表示Na2CO3溶液的作用:。(3)、C中溶液经过滤、、、过滤洗涤、干燥可制得粗产品。(4)、Ⅱ.测定产品纯度称取粗产品12.400g配制成100mL溶液,取25.00mL该溶液于锥形瓶中,用0.2500mol·L-1的I2标准液滴定,反应原理为:I2+2S2O→2I-+S4O , 实验数据如表:
编号
初读数(mL)
末读数(mL)
①
0.00
19.99
②
1.00
21.01
③
1.00
23.00
用作为指示剂,滴定至终点时溶液的颜色由色变为色,且30s内溶液颜色不变。粗产品中Na2S2O3﹒5H2O的质量分数为。下列情况可能导致测量结果偏低的操作是 。
a.粗产品中Na2S2O3﹒5H2O失去部分结晶水
b.滴定前装I2标准液的滴定管未用标准液润洗
c.锥形瓶用蒸馏水洗净后未用待测液润洗
d.滴定时锥形瓶中有少量液滴溅出
24. 科学研究发现含有黄酮类化合物的中药制剂可能对新型冠状肺炎有一定的治疗作用。某黄酮类化合物F的一种合成路线如图,(D、E、F分子中Ar表示某特定基团)。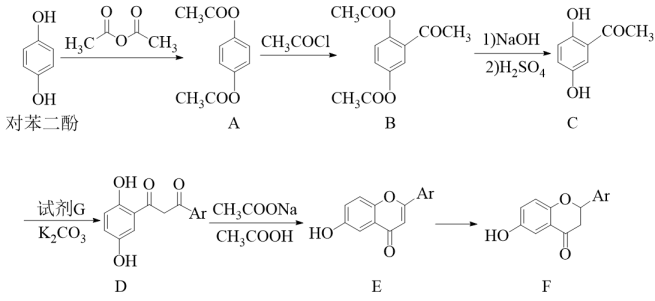
已知:RCOCH3+R′COClRCOCH2COR′+HCl
(1)、对苯二酚的分子式为 , 该分子中含有种化学环境的氢原子。(2)、A→B的反应类型是 , B中含氧官能团的名称为羰基和。(3)、对苯二酚转化为A的目的是。(4)、某芳香族化合物K与C互为同分异构体,写出一种符合下列条件的K的结构简式为。①苯环上有2个取代基
②可发生水解反应和银镜反应
③可与金属钠Na反应生成H2 , 且苯环上的一氯代物只有2种
(5)、写出G的结构简式为。(6)、结合相关信息,以丙酮(CH3COCH3)和 为原料,参照题中所给信息(其它试剂任选)设计合成
为原料,参照题中所给信息(其它试剂任选)设计合成 的路线(不超过三步,无机试剂任选)。
的路线(不超过三步,无机试剂任选)。(合成路线可表示为:AB……目标产物)