2022年中考化学二轮专题复习-水和溶液、溶解度曲线
试卷更新日期:2022-04-09 类型:二轮复习
一、单选题
-
1. 下列有关水的说法正确的是( )A、冰水共存物属于混合物 B、农业上可采用喷灌、滴灌来节水 C、软水中一定不含可溶性钙镁化合物 D、电解水时,正极端玻璃管内产生的气体为氢气2. 把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )A、花生油 B、面粉 C、泥土 D、食盐3. 2021年3月22日至28日是第三十四届“中国水周”,活动的宣传主题为“深入贯彻新发展理念,推进水资源集约安全利用”。下列有关水的说法正确的是( )A、硬水是混合物,软水是纯净物 B、明矾在净水的同时能杀灭水中的细菌和病毒 C、工业用水循环利用可以提高水的利用效益 D、大量使用农药、化肥不会引起水体污染4. 在生产、生活和实验中经常用到水。如图甲为活性炭净水器示意图,如图乙是制取蒸馏水简易装置图,下列说法正确的是( )
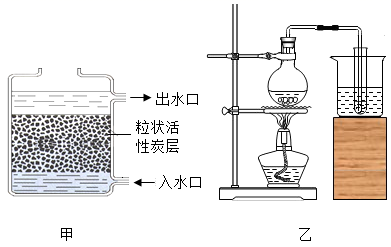 A、图甲中活性炭的作用是杀菌消毒 B、图甲中水流下进上出是为了提高水的净化效果 C、图乙中烧杯内水的作用是密封 D、图乙经过蒸馏后的水仍然是硬水5. 在化学实验操作考查中,小阳同学抽到的考题是“配制50g质量分数为6%的氯化钠溶液”,小阳的实验操作与目的分析均正确的一组是( )
A、图甲中活性炭的作用是杀菌消毒 B、图甲中水流下进上出是为了提高水的净化效果 C、图乙中烧杯内水的作用是密封 D、图乙经过蒸馏后的水仍然是硬水5. 在化学实验操作考查中,小阳同学抽到的考题是“配制50g质量分数为6%的氯化钠溶液”,小阳的实验操作与目的分析均正确的一组是( )选项
实验操作
目的分析
A
称取氯化钠时,指针向右偏,调节游码至天平平衡
准确称量氯化钠质量
B
称取氯化钠时,将剩余的氯化钠放回原瓶
节约药品
C
量取水时,视线与量筒内凹液面最低处保持水平
准确读数
D
溶解氯化钠时,用玻璃棒搅拌
增大氯化钠的溶解度
A、A B、B C、C D、D6. 如图为甲、乙两种固体(不含结晶水)在水中的溶解度曲线,下列说法正确的是( )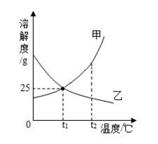 A、甲物质的溶解度大于乙 B、除去甲中少量的乙,用蒸发结晶的方法 C、t1℃时,甲、乙的饱和溶液溶质质量分数都是 25% D、t2℃时,等质量的甲和乙的饱和溶液中,溶剂质量甲<乙7. 氯化钠和硝酸钾在不同温度下的溶解度如下表。下列说法不正确的是( )
A、甲物质的溶解度大于乙 B、除去甲中少量的乙,用蒸发结晶的方法 C、t1℃时,甲、乙的饱和溶液溶质质量分数都是 25% D、t2℃时,等质量的甲和乙的饱和溶液中,溶剂质量甲<乙7. 氯化钠和硝酸钾在不同温度下的溶解度如下表。下列说法不正确的是( )温度
10℃
20℃
30℃
40℃
50℃
60℃
70℃
NaCl溶解度/g
35.8
36.0
36.3
36.6
37.0
37.3
37.8
KNO3溶解度/g
20.9
31.6
45.8
63.9
85.5
110
138
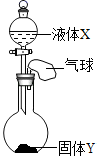
A、硝酸钾晶体中混有少量的氯化钠,可用冷却结晶法提纯硝酸钾 B、40℃时,氯化钠和硝酸钾饱和溶液各100g,含溶质较多的是硝酸钾 C、这两种物质的溶解度曲线的交点,对应的温度应该在20℃-30℃之间 D、20℃时,将20g氯化钠放入50g水中充分搅拌,可得到70g氯化钠溶液8. 如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀。下表中液体X和固体Y的组合,正确的是( )①
②
③
④
X
双氧水
水
水
水
Y
二氧化锰
生石灰
氢氧化钠
硝酸铵
 A、①④ B、②③ C、①③④ D、①②③9. NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是( )
A、①④ B、②③ C、①③④ D、①②③9. NaCl和KNO3的溶解度曲线如图所示,下列说法正确的是( ) A、NaCl的溶解度一定大于KNO3 B、NaCl的溶解度受温度影响的程度比KNO3大 C、40℃时,100gKNO3饱和溶液中含有63.9gKNO3 D、将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g10. 下表提供了A、B两种固体物质的溶解度数据。下列判断正确的是( )
A、NaCl的溶解度一定大于KNO3 B、NaCl的溶解度受温度影响的程度比KNO3大 C、40℃时,100gKNO3饱和溶液中含有63.9gKNO3 D、将60℃时210gKNO3饱和溶液降温至20℃,析出KNO3晶体78.4g10. 下表提供了A、B两种固体物质的溶解度数据。下列判断正确的是( )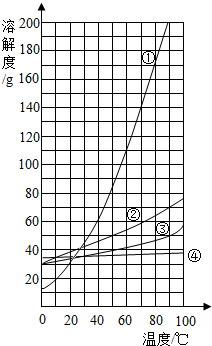
温度℃
0
20
40
60
80
100
溶解度/g
A
27.6
37.0
50.0
59.5
69.1
77.8
B
13.3
36.6
75.9
120
172
246
A、A、B两种物质都属于微溶物 B、40℃时,将20gA加入到50g水中,充分溶解可获得A的饱和溶液 C、60℃时,B物质的饱和溶液中溶质和溶剂的质量比为15:6 D、给出的曲线中①与B物质溶解度变化趋势相符11. 下列关系一定成立的是( )A、50mL酒精与50mL水混合,形成100mL酒精溶液 B、1g石灰石粉末与20g水混合,形成21g溶液 C、3g氢气与24g氧气充分反应,生成27g水 D、10g氢氧化钠稀溶液与10g硫酸铜溶液混合,形成20g混合溶液12. 下列关于电解水的说法中,正确的是( )A、电解水生成的氢气和氧气的质量比约为2:1 B、只有电解水的实验,才能说明水是由氢、氧两种元素组成的 C、电解水产生氢气和氧气,说明水分子中含有氢分子和氧分子 D、与电源负极相连的玻璃管内得到的气体能燃烧,并产生淡蓝色火焰13. 为鉴别硬水与软水,应控制的实验条件有( )
①加入的肥皂水浓度 ②加入的肥皂水的滴数 ③实验时的温度④水样中可溶性钙、镁矿物质的含量 ⑤水样的体积
A、①②③ B、①④⑤ C、①②③⑤ D、①②④⑤14. 要配制100g质量分数为16%的食盐水,下列说法正确的是( )A、实验步骤依次是:称量、量取、计算、溶解 B、实验中用到的仪器:托盘天平、量筒、漏斗、烧杯 C、量取水的体积为100mL D、溶解不能在量筒中进行15. 早在二十世纪初,我国化学家侯德榜在氨碱法制纯碱的基础上,创立了更为先进的侯氏制碱法,生产出Na2CO3的同时得到副产品NH4Cl,促进了世界制碱技术的发展。实验测得Na2CO3和NH4Cl的溶解度曲线如图所示,下列有关说法正确的是( )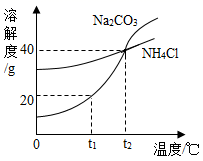 A、NH4Cl的溶解度大于Na2CO3的溶解度 B、t1℃时,100g的Na2CO3饱和溶液中含溶质20g C、t2℃时,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相等 D、将t2℃时Na2CO3和NH4Cl的饱和溶液降温至t1℃,Na2CO3晶体析出的多16. 已知20℃时CuSO4的溶解度为32g。20℃时,取一定质量某CuSO4溶液于烧杯中,按下图进行实验(整个过程中忽略溶剂损失),下列说法错误的是( )
A、NH4Cl的溶解度大于Na2CO3的溶解度 B、t1℃时,100g的Na2CO3饱和溶液中含溶质20g C、t2℃时,Na2CO3和NH4Cl的饱和溶液中溶质质量分数相等 D、将t2℃时Na2CO3和NH4Cl的饱和溶液降温至t1℃,Na2CO3晶体析出的多16. 已知20℃时CuSO4的溶解度为32g。20℃时,取一定质量某CuSO4溶液于烧杯中,按下图进行实验(整个过程中忽略溶剂损失),下列说法错误的是( )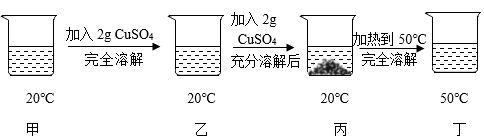 A、溶液中溶质质量分数的大小关系为丁>丙>甲 B、丙中溶液溶质与溶剂的质量比为8:25 C、丁溶液一定是饱和溶液 D、CuSO4 50℃时的溶解度比20℃时的大17. 为探究硝酸钾的溶解性,进行了如图实验(见图Ⅰ),结合KNO3溶解度曲线(见图Ⅱ)判断,下列说法错误的是( )
A、溶液中溶质质量分数的大小关系为丁>丙>甲 B、丙中溶液溶质与溶剂的质量比为8:25 C、丁溶液一定是饱和溶液 D、CuSO4 50℃时的溶解度比20℃时的大17. 为探究硝酸钾的溶解性,进行了如图实验(见图Ⅰ),结合KNO3溶解度曲线(见图Ⅱ)判断,下列说法错误的是( )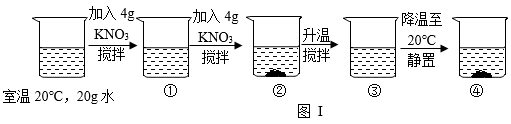
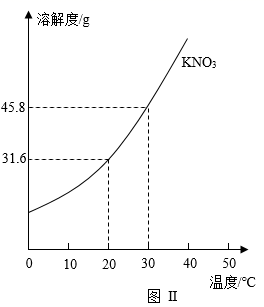 A、溶液②、溶液④一定是饱和溶液 B、溶液①、溶液③一定是不饱和溶液 C、溶液②、溶液③的质量:③>② D、溶液②、溶液③溶液④的溶质质量分数:③>②=④18. 某学习小组的同学用数字传感器探究氯化钠溶于水形成溶液的过程中,氯离子浓度和溶液的电导率的变化,测定结果如图所示。下列说法错误的是( )
A、溶液②、溶液④一定是饱和溶液 B、溶液①、溶液③一定是不饱和溶液 C、溶液②、溶液③的质量:③>② D、溶液②、溶液③溶液④的溶质质量分数:③>②=④18. 某学习小组的同学用数字传感器探究氯化钠溶于水形成溶液的过程中,氯离子浓度和溶液的电导率的变化,测定结果如图所示。下列说法错误的是( ) A、实验过程中溶液的电导率随时间变化会不断增大 B、实验说明氯化钠溶解在水中解离成 Cl-和 Na+ C、一定条件下,电导率的大小能反映离子浓度的大小 D、a~b 段曲线说明氯化钠开始溶解时,溶液中氯离子浓度陡增19. 用溶质质量分数为30%的KNO3溶液和溶质质量分数为10%的KNO3溶液配制溶质质量分数为20%的KNO3溶液,则需溶质质量分数为30%和溶质质量分数为10%的溶液质量比为( )。A、1:1 B、2:1 C、1:3 D、1:420. 在配制质量分数为10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的原因可能是:①用量筒量取水时俯视读数,②配制溶液的烧杯用少量蒸馏水润洗,③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数,④盛装溶液的试剂瓶用蒸馏水润洗,⑤氯化钠晶体不纯( )A、①②③④⑤ B、①②④⑤ C、②③④⑤ D、①②③
A、实验过程中溶液的电导率随时间变化会不断增大 B、实验说明氯化钠溶解在水中解离成 Cl-和 Na+ C、一定条件下,电导率的大小能反映离子浓度的大小 D、a~b 段曲线说明氯化钠开始溶解时,溶液中氯离子浓度陡增19. 用溶质质量分数为30%的KNO3溶液和溶质质量分数为10%的KNO3溶液配制溶质质量分数为20%的KNO3溶液,则需溶质质量分数为30%和溶质质量分数为10%的溶液质量比为( )。A、1:1 B、2:1 C、1:3 D、1:420. 在配制质量分数为10%的氯化钠溶液的过程中,导致溶液中氯化钠质量分数小于10%的原因可能是:①用量筒量取水时俯视读数,②配制溶液的烧杯用少量蒸馏水润洗,③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数,④盛装溶液的试剂瓶用蒸馏水润洗,⑤氯化钠晶体不纯( )A、①②③④⑤ B、①②④⑤ C、②③④⑤ D、①②③二、填空题
-
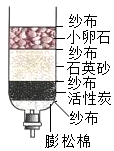
21. 小方学习了水的有关知识后,自制了如图所示的简易净水器,其中,小卵石、石英沙、纱布等都起到了作用,活性炭的主要作用是。
 22. 图是电解水实验装置图,接通电源一段时间后,可观察到a、b集气管内的气体体积比为 , 此反应属于。(填写基本反应类型名称)
22. 图是电解水实验装置图,接通电源一段时间后,可观察到a、b集气管内的气体体积比为 , 此反应属于。(填写基本反应类型名称) 23. 如图是甲、乙两种固体物质的溶解度曲线。温度为℃时甲、乙溶解度相等:将甲物质的不饱和溶液转化为饱和溶液可采用的一种方法是。
23. 如图是甲、乙两种固体物质的溶解度曲线。温度为℃时甲、乙溶解度相等:将甲物质的不饱和溶液转化为饱和溶液可采用的一种方法是。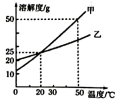 24. 过氧化氢是一种有效的防疫新冠病毒的消毒剂。现有一瓶新售的过氧化氢溶液,标签如图所示,若要配制1500g溶质的质量分数为3%的医用过氧化氢溶液,需用这种过氧化氢溶液的质量是g,需要加水g。(直接填写答案,无需写出计算过程)
24. 过氧化氢是一种有效的防疫新冠病毒的消毒剂。现有一瓶新售的过氧化氢溶液,标签如图所示,若要配制1500g溶质的质量分数为3%的医用过氧化氢溶液,需用这种过氧化氢溶液的质量是g,需要加水g。(直接填写答案,无需写出计算过程) 25. 20℃时,硝酸钠的溶解度为90克,则该温度下硝酸钠饱和溶液中,溶质、溶剂、溶液的质量比是;该温度下硝酸钠饱和溶液中溶质质量分数是。26. 向一定量盐酸和氯化钙的混合溶液中滴加过量的碳酸钠溶液,溶液pH与Na2CO3溶液的质量关系如图所示。则m的值为;bc段发生反应的方程式为。
25. 20℃时,硝酸钠的溶解度为90克,则该温度下硝酸钠饱和溶液中,溶质、溶剂、溶液的质量比是;该温度下硝酸钠饱和溶液中溶质质量分数是。26. 向一定量盐酸和氯化钙的混合溶液中滴加过量的碳酸钠溶液,溶液pH与Na2CO3溶液的质量关系如图所示。则m的值为;bc段发生反应的方程式为。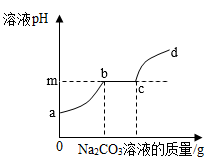 27. 如图是A、B的溶解度曲线。
27. 如图是A、B的溶解度曲线。
t2℃时分别将100gA、B的饱和溶液降温至t1℃,析出固体质量AB(填“>”、“<”或“=”);把t2℃时150gA的饱和溶液稀释为20%,需加水g;配制质量分数为5%的氯化钠溶液,若量取水时俯视量筒刻度读数(其他操作正确),溶液的质量分数5%(填“大于”、“小于”或“等于”)。
28. 某同学用天平称取NaCl固体19g,用量筒量取蒸馏水76mL(水的密度为1g/cm3),配制一定质量分数的氯化钠溶液,该氯化钠溶液的溶质质量分数为 . 若该同学量取水时是仰视读数,则所配制的氯化钠溶液溶质质量分数会(填“偏大”、“不变”、“偏小”).29.已知A~G为初中化学常见的物质.
如图所示“→”表示转化关系,“﹣”表示相互能发生反应.已知A是人体胃液中含有的酸,E是最轻的气体,B和D所含元素相同.
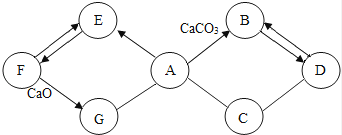
请回答:
(1)写出下列物质的化学式:A ,D .
(2)G物质的一种用途 .
(3)写出F→E的化学反应方程式 ,该反应的基本类型为 反应.
30.20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:
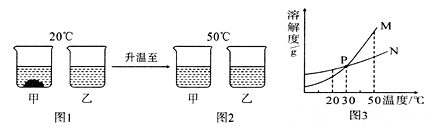
(1)图1中一定为饱和溶液的是。
(2)图2中甲、乙两溶液中溶质质量分数的大小关系为。
(3)图3中表示乙的溶解度曲线是;三、综合题
-
31. 如表是氯化钠和硝酸钾在不同温度下的溶解度,运用溶解度表与溶解度曲线回答下列问题:
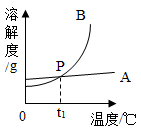
温度/℃
10
30
50
60
溶解度/g
氯化钠
35.8
36.3
37.0
37.3
硝酸钾
20.9
45.8
85.5
110
(1)、图中能表示氯化钠的溶解度曲线是(选填“A”或“B”),P点表示的含义是。(2)、据表格可知,氯化钠和硝酸钾两物质溶解度相等的温度范围在℃之间。(3)、60℃时,100g水中加入90g硝酸钾,充分溶解,所得溶液是(填“饱和”或“不饱和”)溶液。将该溶液降温到10℃时,析出晶体的质量为g。(4)、60℃时,用等质量的氯化钠、硝酸钾分别配制两种饱和溶液,测得其质量依次为m1g和m2g,则m1m2(填或“>”、“<”“=”)。32. 水是生命之源。(1)、遵义市有丰富的山泉水,大部分的山泉水是硬水,需煮沸后饮用。硬水中常含有可溶性的碳酸氢钙,化学式为Ca(HCO3)2 , 在煮沸的过程中,碳酸氢钙发生分解生成碳酸钙、水和二氧化碳,该反应的化学方程式为。(2)、研究水的组成须从纯净的水入手分析,通过电解水实验可知,水是由组成的一种化合物。(3)、水的转化如下图所示,箭头指向一步实现的物质转化方向,反应①②③④分别属于四种不同的基本反应类型。其中②为置换反应,写出一个符合反应②的化学方程式。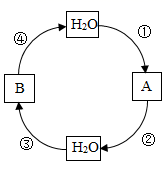 (4)、根据下表信息回答问题。
(4)、根据下表信息回答问题。
0
10
20
30
40
碳酸钠
7.1
12.5
21.5
39.7
49.0
碳酸氢钠
6.9
8.1
9.6
11.1
12.7
①表中物质的溶解度受温度影响较大的是。
②现有两瓶失去标签的固体样品,分别是碳酸钠和碳酸氢钠中的一种。下列鉴别方案正确的是。
A.取两只烧杯,分别加样品各4g,各加50g水溶解,观察现象
B.20℃时,取两只烧杯,分别加样品各6g,各加50g水溶解,观察现象
C.30℃时,取两只烧杯,分别配制两样品的100g饱和溶液,再降温到0℃,观察现象
D.40℃时,取两只烧杯,分别加样品各6g,各加50g水溶解,观察现象
33. 我国有许多盐碱湖,湖中溶有大量的碳酸钠和氯化钠,它们的溶解度曲线如图1所示。碳酸钠是一种重要的化工原料,可用于制取氢氧化钠,工业上制取氢氧化钠的一种方法,如图2所示。 请据图回答: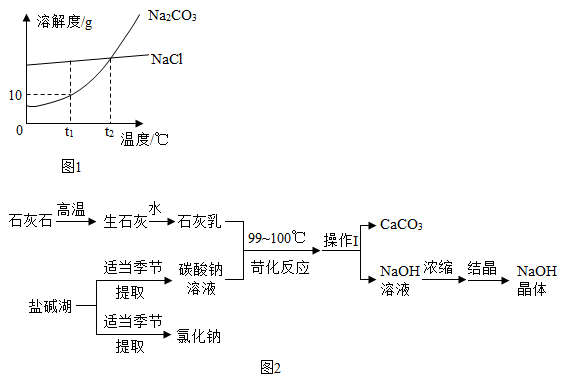 (1)、由石灰石制取石灰乳的过程中,发生反应的一个化学方程式是。(2)、根据图1分析,提取碳酸钠的季节最好是。(3)、苛化反应时将温度升高至99~100℃的原因是 , 操作1中需要用到的一种玻璃仪器是。(4)、配制等浓度的碳酸钠和氯化钠的饱和溶液,需要将温度控制在℃。
(1)、由石灰石制取石灰乳的过程中,发生反应的一个化学方程式是。(2)、根据图1分析,提取碳酸钠的季节最好是。(3)、苛化反应时将温度升高至99~100℃的原因是 , 操作1中需要用到的一种玻璃仪器是。(4)、配制等浓度的碳酸钠和氯化钠的饱和溶液,需要将温度控制在℃。四、实验探究题
-
34. 化学兴趣小组对当地的石灰石进行调查研究,步骤如下:
 (1)、【配置稀盐酸】:实验室现有溶质质量分数为 36.5%的浓盐酸 100 g,稀释成溶质质量分数为 7.3%的稀盐酸用于实验,需要加入水的体积为 mL
(1)、【配置稀盐酸】:实验室现有溶质质量分数为 36.5%的浓盐酸 100 g,稀释成溶质质量分数为 7.3%的稀盐酸用于实验,需要加入水的体积为 mL(ρ水=1.0 g/mL)。若配置上述溶液,实际操作的实验步骤顺序是 (填序号)。
①计算 ②混匀 ③量取 ④称量 ⑤溶解
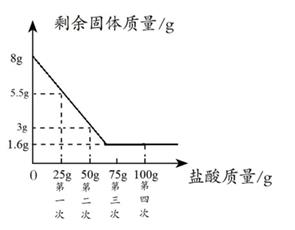
(2)、【实验数据与计算】取该石灰石样品 8 g,把 100g 稀盐酸分四次加入,充分反应。测量过程所得数据如图(已知石灰石样品中含有碳酸钙和杂质,杂质不溶于水、不与稀盐酸反应)。①样品中碳酸钙的质量分数是 ▲ 。
②计算生成二氧化碳的质量。(结果精确到 0.1)
(写出计算过程)
(3)、【计算数据分析与反思】小新同学想根据图像计算所用稀盐酸溶质的质量分数,可选择的实验中 数据。
A、第一次 B、第二次 C、第三次 D、第四次35. 如下图是小江同学配制NaCl溶液的实验操作示意图: (1)、图中的玻璃仪器分别是、玻璃棒、广口瓶和量筒,其中玻璃棒在此操作中的作用是;(2)、指出图②中的一处不正确操作;(3)、通过计算,配制时应选择(填“10”“50”或“100”)mL的量筒量取所需要的水;(4)、用图中的序号表示配制溶液的操作顺序。36. 下列是两个关于水的实验。
(1)、图中的玻璃仪器分别是、玻璃棒、广口瓶和量筒,其中玻璃棒在此操作中的作用是;(2)、指出图②中的一处不正确操作;(3)、通过计算,配制时应选择(填“10”“50”或“100”)mL的量筒量取所需要的水;(4)、用图中的序号表示配制溶液的操作顺序。36. 下列是两个关于水的实验。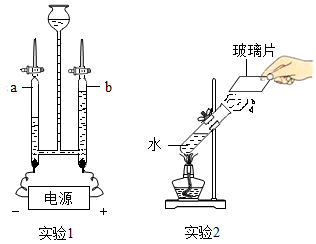 (1)、实验1中,发生反应的化学方程式为。该实验说明水由组成。(2)、下列说法正确的是____(填字母序号)。A、实验1中b管产生的气体能使带火星的木条复燃 B、实验1中原子的种类、个数均不改变 C、实验2中发生的是物理变化 D、实验2中水分子大小改变37. 以下是初中化学一些基本实验,请根据实验内容回答下列问题:(1)、利用下图进行粗盐中难溶性杂质去除和配制一定质量分数氯化钠溶液的实验。
(1)、实验1中,发生反应的化学方程式为。该实验说明水由组成。(2)、下列说法正确的是____(填字母序号)。A、实验1中b管产生的气体能使带火星的木条复燃 B、实验1中原子的种类、个数均不改变 C、实验2中发生的是物理变化 D、实验2中水分子大小改变37. 以下是初中化学一些基本实验,请根据实验内容回答下列问题:(1)、利用下图进行粗盐中难溶性杂质去除和配制一定质量分数氯化钠溶液的实验。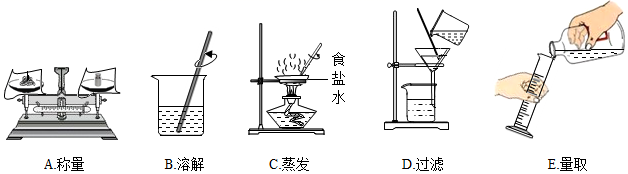
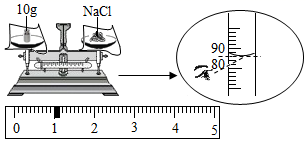
①粗盐中难溶性杂质去除的主要操作顺序是(填字母序号):
②B溶解时用玻璃棒搅拌的目的是。
③配制11%的氯化钠溶液100g。如按下图进行称量和量取,其它操作均规范无误,最终导致配制的氯化钠溶液的溶质质量分数(填“大于”、“小于”或“不能确定”)11%。
④取100g配制好的质量分数为11%的NaCl溶液,稀释成质量分数为5.5%的NaCl溶液,需加水g。
(2)、化学社团的同学在探究化学反应能否产生电能时做了如下实验。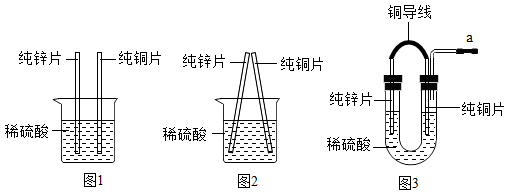
①图1实验中观察到的现象是:锌片表面。
②图2中两种金属触碰后铜(选填“有”或“没有”)发生化学反应。
③图3将锌片、铜片用导线连接后平行插入稀硫酸中,酸溶液中的氢离子从铜片表面获得(选填“锌”或“铜”)失去的电子生成了氢气。
④(延伸应用)制造钢制船闸门时,为防止铁被腐蚀,常在钢闸门表面安装比铁(选“更活泼”或“更不活泼”)的金属。
38. 硬水加热时易产生水垢,很多工业用水需要对硬水进行软化处理。化学兴趣小组同学利用1.5%的肥皂水比较水的硬度。(1)、(交流讨论)硬水是;软水是。
(2)、I.探究水的硬度、肥皂水的用量与产生泡沫量的关系(进行实验)向蒸馏水中加入CaCl2和MgCl2的混合溶液,配制两种不同硬度的硬水。
用蒸馏水和两种硬水完成三组实验,记录如下:
组别
第1组
第2组
第3组
实验操作
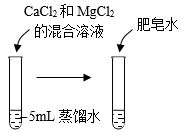
实验序号
①
②
③
④
⑤
⑥
⑦
⑧
⑨
混合溶液用量/滴
0
0
0
1
X
1
2
2
2
肥皂水用量/滴
5
10
20
5
10
20
5
10
20
产生泡沫量
少
多
很多
无
少
多
无
无
少
(解释与结论)
对比②和⑧可知,肥皂水能区分软水和硬水,依据的现象是。
(3)、设计第2组实验时,为控制水的硬度相同,⑤中X应为。(4)、第2组实验的目的是。(5)、由上述三组实验得到的结论是。(6)、Ⅱ.比较不同水样的硬度(进行实验)用四种水样完成实验,记录观察到泡沫产生时所需肥皂水的用量。
实验操作
水样
肥皂水用量/滴
市售纯净水
2
煮沸后的自来水
6
自来水
9
湖水
14
(解释与结论)
硬度最大的水样是。
(7)、由上述实验可知,能将自来水硬度降低的方法有。五、计算题
-
39. 为测定某石灰石样品中碳酸钙的含量,化学小组先用30%的浓盐酸20g,配制10%的稀盐酸,并加入到13g 的石灰石样品中完全反应。(最后结果保留1位小数)(1)、配制10%的稀盐酸质量。(2)、生成二氧化碳的质量。(3)、石灰石样品中碳酸钙的质量分数。40. 过氧化氢是一种绿色化学试剂,在化学研究及生活中应用广泛,如医疗上常用质量分数为3%的过氧化氢溶液进行伤口消毒.
(1)实验室现有质量分数为30%的过氧化氢溶液和二氧化锰等药品,小明要制取16g氧气,需要30%的过氧化氢溶液的质量是多少?(写出计算过程,计算结果保留一位小数).
(2)小明在实验过程中发现产生氧气的速度过快,通过查阅资料得知,过氧化氢浓度大是导致反应速度快的主要原因.为此,小明想配制质量分数为3%的过氧化氢溶液200g.计算需30%的过氧化氢溶液多少克?需水多少克?