冲刺2021高考化学押题训练(十一)非金属及其化合物
试卷更新日期:2021-05-21 类型:三轮冲刺
一、单选题
-
1. 下列有关实验装置和原理能达到实验目的的是( )
A
B
C
D
测量锌粒和3 mol/L硫酸反应生成H2的体积
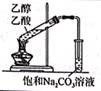
制备并收集乙酸乙酯
加热熔融的纯碱固体
制取并收集SO2


 A、A B、B C、C D、D2. 下列关于物质的制备、生产的说法正确的是( )A、工业制取金属铝:电解熔融Al2O3 B、实验室制取NH3:可用无水CaCl2干燥 C、用镁粉和空气反应制备Mg3N2 D、NaI溶液与浓H2SO4混合制备HI3. 生产、生活中蕴含了丰富的化学知识,下列有关说法正确的是( )A、氮氧化物的大量排放,会导致光化学烟雾、酸雨和温室效应等环境问题 B、500米口径球面射电望远镜被誉为“中国天眼”,其“眼眶”是钢铁结成的圈梁,属于新型纯金属材料 C、抗新冠疫情过程中,公共场所常用“84消毒液”消毒处理,该物质的有效成分是次氯酸钙 D、水煤气合成甲醇等含氧有机物及液态烃的过程属于煤的液化,实现了煤的综合利用4. 生活离不开化学,下列行为不合理或有常识性错误的是( )A、用明矾可消除水中Cu2+等重金属离子污染 B、上饶市在创全国文明城市,为符合题意响应“垃圾分一分,环境美十分”的口号,可把坚果壳放到标有
A、A B、B C、C D、D2. 下列关于物质的制备、生产的说法正确的是( )A、工业制取金属铝:电解熔融Al2O3 B、实验室制取NH3:可用无水CaCl2干燥 C、用镁粉和空气反应制备Mg3N2 D、NaI溶液与浓H2SO4混合制备HI3. 生产、生活中蕴含了丰富的化学知识,下列有关说法正确的是( )A、氮氧化物的大量排放,会导致光化学烟雾、酸雨和温室效应等环境问题 B、500米口径球面射电望远镜被誉为“中国天眼”,其“眼眶”是钢铁结成的圈梁,属于新型纯金属材料 C、抗新冠疫情过程中,公共场所常用“84消毒液”消毒处理,该物质的有效成分是次氯酸钙 D、水煤气合成甲醇等含氧有机物及液态烃的过程属于煤的液化,实现了煤的综合利用4. 生活离不开化学,下列行为不合理或有常识性错误的是( )A、用明矾可消除水中Cu2+等重金属离子污染 B、上饶市在创全国文明城市,为符合题意响应“垃圾分一分,环境美十分”的口号,可把坚果壳放到标有 图标的垃圾桶内
C、75%(体积分数)的酒精、含氯消毒剂、过氧乙酸均可以有效灭活新型冠状病毒
D、蚕丝和棉纤维灼烧后产生的气味不同
5. 硫酸盐(含SO 、HSO )气溶胶是PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下。下列说法错误的是( )
图标的垃圾桶内
C、75%(体积分数)的酒精、含氯消毒剂、过氧乙酸均可以有效灭活新型冠状病毒
D、蚕丝和棉纤维灼烧后产生的气味不同
5. 硫酸盐(含SO 、HSO )气溶胶是PM2.5的成分之一。近期科研人员提出了雾霾微颗粒中硫酸盐生成的转化机理,其主要过程示意图如下。下列说法错误的是( ) A、该过程中有H2O参与反应 B、硫酸盐气溶胶呈酸性 C、NO2是生成硫酸盐的催化剂 D、该过程中有氧氢键断裂6. 2020年11月24日,嫦娥五号探测器发射圆满成功,开启我国首次地外天体采样返回之旅。探月工程所选用的新材料与化学有密切相关。下列叙述正确的是( )A、登月中,所用北斗系统的导航卫星,其计算机的芯片材料是高纯度二氧化硅 B、用于光学望远镜的高致密碳化硅特种陶瓷材料,是一种传统无机非金属材料 C、面对高空低压的环境,所使用的碳纤维是一种有机高分子材料 D、嫦娥五号探测器在月球表面展示的国旗,其材料要求具有耐高低温、防静电等多种特性,所用的高性能芳纶纤维材料是复合材料7. 2020年我国在科技领域取得了很多与化学密切相关的成就。下列说法正确的是( )A、“中国天眼”所用到的超高耐疲劳性能钢索是一种新型有机高分子材料 B、北斗三号全球卫星导航系统正式开通,其导航型芯片的主要成分是二氧化硅 C、嫦娥5号卫星带回的月壤中富含“完美能源3He,3He与4He互为同素异形体 D、“奋斗者号”成功坐底万米深海,外壳材料利用了新型钛合金坚固、耐腐蚀等性能8. 化学与人类生活、生产和社会可持续发展密切相关,下列有关说法错误的是( )A、燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 B、中国华为自主研发的5G芯片巴龙5000的主要材料是Si C、N95口罩的主要材质聚丙烯叮利用丙烯加聚合成 D、国产新冠灭活疫苗需冷冻保存以防发生变性9. 下列实验方案中,能达到实验目的是( )
A、该过程中有H2O参与反应 B、硫酸盐气溶胶呈酸性 C、NO2是生成硫酸盐的催化剂 D、该过程中有氧氢键断裂6. 2020年11月24日,嫦娥五号探测器发射圆满成功,开启我国首次地外天体采样返回之旅。探月工程所选用的新材料与化学有密切相关。下列叙述正确的是( )A、登月中,所用北斗系统的导航卫星,其计算机的芯片材料是高纯度二氧化硅 B、用于光学望远镜的高致密碳化硅特种陶瓷材料,是一种传统无机非金属材料 C、面对高空低压的环境,所使用的碳纤维是一种有机高分子材料 D、嫦娥五号探测器在月球表面展示的国旗,其材料要求具有耐高低温、防静电等多种特性,所用的高性能芳纶纤维材料是复合材料7. 2020年我国在科技领域取得了很多与化学密切相关的成就。下列说法正确的是( )A、“中国天眼”所用到的超高耐疲劳性能钢索是一种新型有机高分子材料 B、北斗三号全球卫星导航系统正式开通,其导航型芯片的主要成分是二氧化硅 C、嫦娥5号卫星带回的月壤中富含“完美能源3He,3He与4He互为同素异形体 D、“奋斗者号”成功坐底万米深海,外壳材料利用了新型钛合金坚固、耐腐蚀等性能8. 化学与人类生活、生产和社会可持续发展密切相关,下列有关说法错误的是( )A、燃煤中加入CaO可以减少酸雨的形成及温室气体的排放 B、中国华为自主研发的5G芯片巴龙5000的主要材料是Si C、N95口罩的主要材质聚丙烯叮利用丙烯加聚合成 D、国产新冠灭活疫苗需冷冻保存以防发生变性9. 下列实验方案中,能达到实验目的是( )实验目的
实验方案
A
验证H2O2具有氧化性
向0.1 mol·L-1 KMnO4溶液中滴加0.1 mol·L-1H2O2溶液,可观察到溶液褪色
B
证明铜与浓硫酸反应有SO2生成
将浓硫酸滴加到放有铜片的试管中,并将蘸有品红溶液的湿滤纸置于试管口
C
比较Ksp(AgI)与Ksp(AgCl) 的大小关系
向浓度均为0.05mol·L-1的NaI、NaCl混合溶液中滴加足量AgNO3溶液,观察所产生沉淀的颜色
D
确定NaCl溶液中是否混有Na2CO3
取少量待测液,滴加CaCl2溶液,观察是否出现白色浑浊
A、A B、B C、C D、D10. 下列有关说法正确的是( )A、储热材料芒硝可用于光能-热能的直接转换 B、垃圾焚烧处理法能有效利用生活垃圾中的生物质能 C、利用在微生物作用下分解水并释放出能量,是氢气制取的一个重要研究方向 D、太阳能、可燃冰资源丰富,在使用时对环境无污染或污染很小,且都可以再生,是最有希望的未来新能源11. 下列说法错误的是( )A、工业上以氯气和石灰乳为原料制取漂白粉 B、75% (体积分数)酒精溶液能使蛋白质变性,其消毒效果比无水酒精好 C、钠是一种强还原剂,可用于制取钛、铌等金属 D、在工业炼铁中,焦炭的作用是直接还原铁矿石12. 在给定条件下,下列选项中所示的物质间转化均能实现的是( )A、SiO2 H2SiO3 Na2SiO3 B、S SO2 BaSO3 C、CuSO4 Cu(OH)2 Cu2O D、饱和NaCl溶液 NaHCO3 Na2CO313. 下列有关实验的说法,错误的是( )A、分离及检验海带中的碘元素时,需要向海带灰的浸取液中加入少量硫酸和过氧化氢溶液 B、可用新制的Cu(OH)2悬浊液检验牙膏中存在的甘油 C、实验时酸或碱溅到眼中,应立即用水反复冲洗,并不断眨眼,不能用手搓揉眼睛 D、将移液管中液体放出时,移液管不能与容器内壁接触,以免污染试剂14. 下列说法错误的是( )A、水玻璃、硅胶、汽油、漂粉精都是混合物 B、浓氨水中滴加FeCl3溶液可制得Fe(OH)3胶体 C、硅酸盐Ca2Mg5Si8O22(OH)2可用氧化物的形式表示为:2CaO·5MgO·8SiO2·H2O D、电解质溶液导电,电能转化为化学能15. 室温下,进行下列实验,根据实验操作和现象所得的结论正确的是( )选项
实验操作和现象
结论
A
向NaOH固体中加入少量稀盐酸,测得溶液温度高于室温
盐酸与氢氧化钠的反应为放热反应
B
向Na2SO3溶液中,加入BaCl2溶液,产生白色沉淀,过滤洗涤后,向所得沉淀中加入足量稀硝酸,沉淀不溶解
原Na2SO3溶液已变质
C
向pH=3的醋酸溶液中,加入醋酸铵溶液,溶液pH增大
醋酸铵溶液呈碱性
D
向含有少量CuCl2的MgCl2溶液中,滴加几滴氨水,产生蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
A、A B、B C、C D、D16. 为探究新制氯水的性质,某学生做了如下实验。其中涉及离子反应方程式书写正确的是( )实验
装置
试剂X
现象
①

滴有酚酞的NaOH溶液
溶液红色褪色
②
NaHCO3溶液
产生气泡
③
HNO3酸化的AgNO3溶液
产生白色沉淀
④
FeCl2溶液、KSCN溶液
溶液变红
A、实验①:Cl2+2NaOH=Cl-+ClO-+2Na++H2O B、实验②: +HClO=ClO-+CO2↑+H2O C、实验③:ClO-+Ag++H2O=AgCl↓+2OH- D、实验④:Cl2+2Fe2+=2Fe3++2Cl-17. 下列有关二氧化硫的说法正确的是( )A、SO2属于电解质 B、SO2为非极性分子 C、SO2既有氧化性又有还原性 D、SO2易溶于水是因为与水能形成分子间氢键18. 大国重器彰显中国实力,化学材料助力科技成果转化运用。下列说法正确的是( )A、“蛟龙号”载人潜水器使用的钛合金是金属材料 B、“C919”大飞机使用的氮化硅陶瓷是传统硅酸盐材料 C、“玉兔二号”月球车使用的太阳能电池板材料是二氧化硅 D、“山东舰”航母使用的碳纤维是一种新型有机高分子材料19. 据图中氮元素及其化合物的转化关系,判断下列说法错误的是( ) A、X是N2O5 B、由NH3→N2 , 从原理上看,NH3可与NO2反应生成N2 C、工业上以NH3、空气、水为原料生产硝酸 D、可用NaOH溶液处理多余的NO气体20. 我国在科技上不断取得重大成果,下列说法正确的是( )A、嫦娥五号月面五星红旗的面料“芳纶”属于合成纤维 B、嫦娥五号登月采集的样本中含有3He,与地球上的2He 互为同素异形体 C、我国开采的海底可燃冰是可以燃烧的水 D、中国“奋斗者”号万米载人潜水器的钛合金材料属于新型高分子材料21. 2020国际陶瓷产业博览会在湖南(醴陵)开幕,以下关于陶瓷说法正确的是( )A、CaCO3是陶瓷的主要成分 B、烧结黏土制陶瓷属于物理变化 C、“雨过天晴云破处”所描述瓷器的青色与氧化铁有关 D、某种硅酸盐的主要成分为KAlSi3O8 , 用氧化物形式表示为22. 下列说法正确的是( )A、N2O5属于酸性氧化物 B、蔗糖和铁都属于非电解质 C、CO2、SO2、NO2均为空气污染物 D、氧化钙常用在食品袋中做“去氧剂”23. 部分含氯物质的分类与相应氯元素的化合价关系下图所示。下列说法错误的是( )
A、X是N2O5 B、由NH3→N2 , 从原理上看,NH3可与NO2反应生成N2 C、工业上以NH3、空气、水为原料生产硝酸 D、可用NaOH溶液处理多余的NO气体20. 我国在科技上不断取得重大成果,下列说法正确的是( )A、嫦娥五号月面五星红旗的面料“芳纶”属于合成纤维 B、嫦娥五号登月采集的样本中含有3He,与地球上的2He 互为同素异形体 C、我国开采的海底可燃冰是可以燃烧的水 D、中国“奋斗者”号万米载人潜水器的钛合金材料属于新型高分子材料21. 2020国际陶瓷产业博览会在湖南(醴陵)开幕,以下关于陶瓷说法正确的是( )A、CaCO3是陶瓷的主要成分 B、烧结黏土制陶瓷属于物理变化 C、“雨过天晴云破处”所描述瓷器的青色与氧化铁有关 D、某种硅酸盐的主要成分为KAlSi3O8 , 用氧化物形式表示为22. 下列说法正确的是( )A、N2O5属于酸性氧化物 B、蔗糖和铁都属于非电解质 C、CO2、SO2、NO2均为空气污染物 D、氧化钙常用在食品袋中做“去氧剂”23. 部分含氯物质的分类与相应氯元素的化合价关系下图所示。下列说法错误的是( ) A、a 与d,a与e在酸性情况下反应,均可以得到b B、c 为一种新型自来水消毒剂,代替 b的原因是:c的毒性更小 C、b 的水溶里加入 CaCO3 , 可以增加d的产量 D、消毒液可用于环境消毒,主要是因为含有d,e的固体可用于实验室制O2
A、a 与d,a与e在酸性情况下反应,均可以得到b B、c 为一种新型自来水消毒剂,代替 b的原因是:c的毒性更小 C、b 的水溶里加入 CaCO3 , 可以增加d的产量 D、消毒液可用于环境消毒,主要是因为含有d,e的固体可用于实验室制O2二、多选题
-
24. 工业上除去NO的一种反应机理如图所示。下列说法中正确的是( )
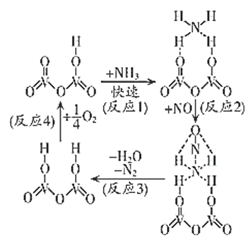 A、该反应的氧化剂为NO、O2 B、反应1决定整个反应的速率快慢 C、反应过程中V元素的化合价未发生变化 D、反应中除去1molNO,消耗1molNH3
A、该反应的氧化剂为NO、O2 B、反应1决定整个反应的速率快慢 C、反应过程中V元素的化合价未发生变化 D、反应中除去1molNO,消耗1molNH3三、实验探究题
-
25. 碘是人体不可缺少的微量元素,也是制造各种无机及有机碘化物的重要原料。利用卤水(含有F)可提取碘。(1)、采用离子交换法从卤水中提取碘的工艺流程如下:
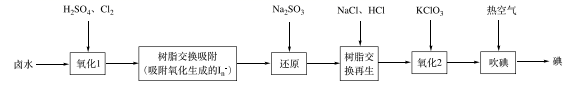
①“氧化1”中生成 ,其反应的离子方程式为。
②“还原”中溶液里含有 , 检验 的实验操作是。
③“吹碘”中通入热空气,利用了碘具有的性质。
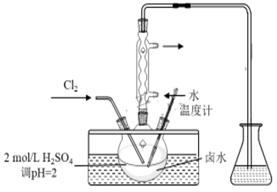
(2)、某实验小组采用如图所示装置、40℃水浴加热制取碘。实验过程中需要控制Cl2用量,否则酸性条件下过量Cl2能将I2进一步氧化成 。请补充完整检验反应后的三颈烧瓶中溶液是否含有 的实验方案:取适量三颈烧瓶中的溶液,。已知反应: +5I-+6H+=3I2+3H2O,实验中可选用的试剂:2mol·L-1硫酸、1 mol·L-1KI溶液、淀粉溶液、CCl4。
 (3)、为测定卤水样品中I的含量,进行下列实验:
(3)、为测定卤水样品中I的含量,进行下列实验:①取2.500L卤水样品减压浓缩至20.00mL,加入过量的0.1500mol·L-1CuCl2溶液20.00mL。
②密封静置2h,生成白色沉淀(发生反应为2Cu2++4I-=I2+2CuI↓)。
③用电感耦合等离子体发射光谱仪测定反应后溶液中c(Cu2+)=0.0125 mol·L-1。
根据上述实验数据,计算卤水样品中I的含量(单位mg·L-1 , 溶液混合前后总体积变化不计,写出计算过程):。
26. 实验室利用SO2合成硫酰氯(SO2Cl2),并对H2SO3和HClO的酸性强弱进行探究。(1)、Ⅰ.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,在空气中遇水蒸气发生剧烈反应,并产生大量白雾,100℃以上分解生成SO2和Cl2.实验室合成SO2Cl2的原理:SO2(g)+Cl2(g) SO2Cl2(l) ΔH<0,实验装置如图所示(夹持仪器已省略),请回答下列问题:
装置A中的试剂是。
(2)、活性炭的作用是。(3)、在冰水浴中制备SO2Cl2的原因是。(4)、为了测定SO2Cl2产品纯度(杂质不参与反应),称取a g SO2Cl2产品于锥形瓶中,加入足量蒸馏水,充分反应。用c mol·L-1 AgNO3溶液滴定反应后的溶液,滴几滴K2CrO4溶液做指示剂,当生成Ag2CrO4砖红色沉淀时,认为溶液中Cl-沉淀完全,此时消耗AgNO3溶液的体积为V mL。①用棕色滴定管盛装AgNO3溶液,其原因是。
②该SO2Cl2产品的纯度为。
(5)、Ⅱ.选用下面的装置探究酸性:H2SO3>HClO,其连接顺序为A→。能证明H2SO3的酸性强于HClO的实验现象为。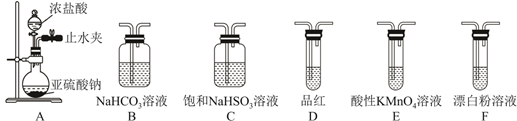 27. 及 是中学化学常用试剂,某兴趣小组设计如下实验探究试剂性质。
27. 及 是中学化学常用试剂,某兴趣小组设计如下实验探究试剂性质。Ⅰ. 的强氧化性
采用下列装置,对浓硝酸与木炭的反应进行探究。请回答下列问题:
 (1)、检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,立即伸入三颈瓶中,并塞紧瓶塞,滴加浓硝酸,三颈烧瓶中的化学反应方程式是。(2)、从实现的功能上来说,装置B的名称是。(3)、装置C中盛有足量 溶液,C中可能观察到的现象是 , 溶液(填“能”或“不能”)用 溶液代替。(4)、装置D中收集到无色气体,部分同学认为是 ,还有部分同学认为是 。假设装置内空气已排净,D瓶中收集的气体仅为产物。下列对该气体的检验方法合适的是___________(填字母)。A、将试剂瓶取出,放在通风条件良好的桌上敞口观察集气瓶内气体的颜色是否变红 B、将润湿的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变蓝 C、将带火星的木条伸入集气瓶中,观察木条是否复燃(5)、Ⅱ. 的热稳定性
(1)、检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,立即伸入三颈瓶中,并塞紧瓶塞,滴加浓硝酸,三颈烧瓶中的化学反应方程式是。(2)、从实现的功能上来说,装置B的名称是。(3)、装置C中盛有足量 溶液,C中可能观察到的现象是 , 溶液(填“能”或“不能”)用 溶液代替。(4)、装置D中收集到无色气体,部分同学认为是 ,还有部分同学认为是 。假设装置内空气已排净,D瓶中收集的气体仅为产物。下列对该气体的检验方法合适的是___________(填字母)。A、将试剂瓶取出,放在通风条件良好的桌上敞口观察集气瓶内气体的颜色是否变红 B、将润湿的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变蓝 C、将带火星的木条伸入集气瓶中,观察木条是否复燃(5)、Ⅱ. 的热稳定性受热易分解,用如图装置加热 固体,试管内有红棕色气体生成,一段时间后,在末端导管口可收集到无色气体a。

气体a的名称是。
(6)、若B中只生成一种盐,则 受热分解的化学方程式为。(7)、上述实验装置存在的安全隐患为。四、综合题
-
28. 2020年初,突如其来的新型冠状肺炎在全世界肆虑,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂。氯酸钠还原法是目前使用较为广泛的ClO2制备方法,其中一种是用NaClO3与CH3OH在催化剂、60℃时,发生反应得到ClO2 , 下图装置(夹持装置略)对其制备、吸收、释放进行了研究。

已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常
用稳定剂吸收ClO2 , 生成NaClO2 , 使用时加酸只释放出ClO2一种气体;②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O;③有关物质沸点如下表:
物质
CH3OH
HCOOH
ClO2
沸点
64.7 ℃
100.8 ℃ .
11 ℃
请回答:
(1)、仪器d的名称是 , 仪器b的作用是。(2)、反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式。(3)、在ClO2释放实验中,发生的离子反应方程式是。(4)、根据反应条件判断制备装置甲中需改进的一项措施是。(5)、NaOH吸收ClO2尾气,生成物质的量为1:1的两种阴离子,一种为ClO2- , 则另一种为。(6)、自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取200.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用0.1000 mol/LNa2S2O3标准溶液滴定碘单质(I2+2S2O32-=2I-+S4O62- ),达到滴定终点时用去20.00mLNa2S2O3标准溶液,测得该水样中ClO2的含量为mg/L( 保留一位小数)。29. 硫及其化合物在工业生产、生活中有重要的用途。(1)、S、Cl、N三种元素常见的氢化物中,写出属于非电解质的电子式。(2)、已知PbS与O2在高温时生成铅的氧化物和SO2 , 化学平衡常数(K)的表达式为:K= 。写出上述反应的化学方程式。(3)、SO2、Na2S2O3、Na2S、Na2SO3、Na2SO4是五种含硫的化合物。①上述物质中,涉及元素形成简单离子半径由大到小的顺序是。
②Na2S又称臭碱,用离子方程式说明Na2S溶液呈碱性的原因。
③Na2SO3溶液中各离子浓度由大到小的顺序是。
④棉织物用氯气漂白后,加入Na2S2O3除去余氯时生成SO ,写出该反应的离子方程式。若反应中生成2molSO ,则转移电子 mol。
30. 汽车尾气中NOx(NO、NO2等)是形成雾霾及硝酸型酸雨的大气污染物之一、(1)、①尿素[CO(NH2)2]在一定条件下可以直接还原NO生成N2 , 发生反应的化学方程式为。②尿素水溶液高于160℃时水解生成NH3和CO2 , 可作为处理NO反应的氨源。通过调整尿素喷入量与汽车尾气流速,得到相同时间内不同投料比[n(尿素)/n(NO)]时NO的转化率随温度变化的a、b的两条曲线如图1所示。
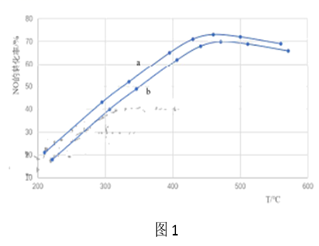
i.曲线a和曲线b,投料比较大的曲线是。(选填“a”或“b”)
ii.当200℃<T<450℃时,NO的转化率随温度升高而增大,原因时温度升高, , 反应速率加快。
(2)、在催化剂Rh表面CO还原NO基元反应机理路径如图2表示,两个N(s)结合生成的N2称为β-N2 , N2O(s)解离生成的N2称为δ-N2 , 基元反应速率随温度的变化关系如图3所示。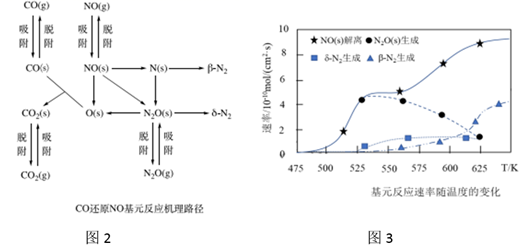
下列说法正确的是_______(填写字母序号)
A、在催化剂表面NO的吸附并解离是反应发生的先决条件 B、在催化剂表面CO2的及时脱附有利于反应的进行 C、当温度超过625K时,生成的N2主要是由CO还原N2O生成的 D、当温度低于530K时,发生的主要反应为2NO+CO=N2O+CO2 E、寻找低温下高效的催化剂控制汽车尾气的污染是未来研究的方向(3)、利用汽车燃油不完全燃烧产物中的CO、HC(还原性的碳氢化合物)作还原剂,在三元催化器作用下可高效去除汽车尾气中的NOx。已知:可燃混合气中空气质量与燃油质量之比为空燃比。CO、HC及NOx转化效率随空燃比的变化关系如图4表示。当空燃比>15时,NOx转化率降低,其可能原因是。
-