冲刺2021高考化学押题训练(五)元素周期表和元素周期律
试卷更新日期:2021-05-18 类型:三轮冲刺
一、单选题
-
1. 科学家合成一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期。下列说法正确的是( )
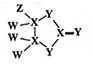 A、X的氢化物均为气体 B、原子半径:X<Y C、Y与W形成的所有化合物仅含有极性共价键 D、ZY2 作为一种高效安全绿色杀菌剂,在自来水消毒等方面应用广泛2. 位于三个不同周期的五种短周期主族元素F、W、X、Y、Z,其中W、Y、Z分别位于三个不同周期,F、Y位于同一主族;Y原子的最外层电子数是W原子的最外层电子数的2倍;W、X、Y三种简单离子的核外电子排布相同。由W、X、Y、Z形成的某种化合物的结构如图所示,下列说法正确的是( )
A、X的氢化物均为气体 B、原子半径:X<Y C、Y与W形成的所有化合物仅含有极性共价键 D、ZY2 作为一种高效安全绿色杀菌剂,在自来水消毒等方面应用广泛2. 位于三个不同周期的五种短周期主族元素F、W、X、Y、Z,其中W、Y、Z分别位于三个不同周期,F、Y位于同一主族;Y原子的最外层电子数是W原子的最外层电子数的2倍;W、X、Y三种简单离子的核外电子排布相同。由W、X、Y、Z形成的某种化合物的结构如图所示,下列说法正确的是( ) A、W、F、X的最高价氧化物的水化物两两不能发生反应 B、因为Y比F的氢化物稳定,所以Y的氢化物沸点高于F C、X与Y、Y与Z形成原子个数比1:1的化合物中,所含化学键类型完全相同 D、W元素所在周期的主族元素简单离子半径比较中,W的离子半径最小3. 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其结构示意图如下(实线代表共价键,其他重复单元的W、X未标注),W、X、Z分别位于不同周期,Z的原子半径在同周期中最大。下列说法错误的是( )
A、W、F、X的最高价氧化物的水化物两两不能发生反应 B、因为Y比F的氢化物稳定,所以Y的氢化物沸点高于F C、X与Y、Y与Z形成原子个数比1:1的化合物中,所含化学键类型完全相同 D、W元素所在周期的主族元素简单离子半径比较中,W的离子半径最小3. 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其结构示意图如下(实线代表共价键,其他重复单元的W、X未标注),W、X、Z分别位于不同周期,Z的原子半径在同周期中最大。下列说法错误的是( ) A、Y单质的氧化性在同周期元素形成的单质中最强 B、Z与Y可能组成多种离子化合物 C、ZW与水反应生成W2的反应中,ZW为还原剂 D、Y的最简单氢化物热稳定性大于X4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是内层电子数的2倍,Y是地壳中含量最多的元素,Z元素的金属性在短周期中最强,W与Y位于同一主族。下列说法正确的是( )A、简单离子半径:Y<Z< W B、Y与Z组成的化合物中不可能含共价键 C、X的简单气态氢化物的热稳定性比Y的弱 D、X的最高价氧化物对应水化物的酸性比W的强5. W、X、Y和Z为原子序数依次增大的四种短周期主族元素。W原子的最外层电子数是其内层电子数的2倍;含元素X的合金是日常生活中广泛使用的金属材料之一;Y的最高正价与最低负价的代数和为4。下列叙述正确的是( )A、简单离子半径:Y>Z B、简单气态氢化物的热稳定性: Y> Z C、W的最高价氧化物对应的水化物为强酸 D、工业上可用电解熔融XZ3的方法制备单质X6. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的最高价氧化物固态时可用作人工降雨剂或用于冷藏食品,X、Y的最外层电子数之和与W的最外层电子数相等,W的简单氢化物与Z的单质混合光照可生成Z的氢化物和油状混合物。下列说法正确的是( )A、原子半径:W>X>Y>Z B、X、Y的简单离子的电子层结构相同 C、W的简单氢化物的稳定性比Z的强 D、Z分别与W、X形成的化合物中所含化学键类型相同7. A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期。X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示。下列说法正确的是( )
A、Y单质的氧化性在同周期元素形成的单质中最强 B、Z与Y可能组成多种离子化合物 C、ZW与水反应生成W2的反应中,ZW为还原剂 D、Y的最简单氢化物热稳定性大于X4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是内层电子数的2倍,Y是地壳中含量最多的元素,Z元素的金属性在短周期中最强,W与Y位于同一主族。下列说法正确的是( )A、简单离子半径:Y<Z< W B、Y与Z组成的化合物中不可能含共价键 C、X的简单气态氢化物的热稳定性比Y的弱 D、X的最高价氧化物对应水化物的酸性比W的强5. W、X、Y和Z为原子序数依次增大的四种短周期主族元素。W原子的最外层电子数是其内层电子数的2倍;含元素X的合金是日常生活中广泛使用的金属材料之一;Y的最高正价与最低负价的代数和为4。下列叙述正确的是( )A、简单离子半径:Y>Z B、简单气态氢化物的热稳定性: Y> Z C、W的最高价氧化物对应的水化物为强酸 D、工业上可用电解熔融XZ3的方法制备单质X6. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的最高价氧化物固态时可用作人工降雨剂或用于冷藏食品,X、Y的最外层电子数之和与W的最外层电子数相等,W的简单氢化物与Z的单质混合光照可生成Z的氢化物和油状混合物。下列说法正确的是( )A、原子半径:W>X>Y>Z B、X、Y的简单离子的电子层结构相同 C、W的简单氢化物的稳定性比Z的强 D、Z分别与W、X形成的化合物中所含化学键类型相同7. A、B、C、D、E为原子序数依次增大的短周期主族元素,分布在三个不同周期。X、Y、Z、W为这些元素形成的化合物,X为二元化合物且为强电解质,W的水溶液呈碱性,物质的转化关系如图所示。下列说法正确的是( ) A、离子半径:C >D>B B、化合物Y中既有离子键又有共价键 C、电解熔融状态下的化合物Z,可制备D的单质 D、往X溶液中逐滴滴入W溶液,现象是:先产生沉淀,后沉淀溶解8. X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示,其中R元素是短周期中除稀有气体元素之外原子半径最大的元素。下列说法正确的是( )
A、离子半径:C >D>B B、化合物Y中既有离子键又有共价键 C、电解熔融状态下的化合物Z,可制备D的单质 D、往X溶液中逐滴滴入W溶液,现象是:先产生沉淀,后沉淀溶解8. X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示,其中R元素是短周期中除稀有气体元素之外原子半径最大的元素。下列说法正确的是( ) A、M元素在元素周期表中的位置是第2周期VIA族 B、元素的氢化物的稳定性:Y>Z C、Y元素与X元素只能形成一种共价化合物 D、Y、R的单质分别都能与其他物质反应置换出X单质9. X、Y、Z、W为原子序数依次增大的前四周期元素,基态原子中,X为元素周期表中半径最小的原子,Z原子最外层电子数为次外层电子数的三倍,W原子的价电子排布为3d104s1 , X、Y、Z、W形成的阳离子如图所示,下列说法正确的是( )
A、M元素在元素周期表中的位置是第2周期VIA族 B、元素的氢化物的稳定性:Y>Z C、Y元素与X元素只能形成一种共价化合物 D、Y、R的单质分别都能与其他物质反应置换出X单质9. X、Y、Z、W为原子序数依次增大的前四周期元素,基态原子中,X为元素周期表中半径最小的原子,Z原子最外层电子数为次外层电子数的三倍,W原子的价电子排布为3d104s1 , X、Y、Z、W形成的阳离子如图所示,下列说法正确的是( )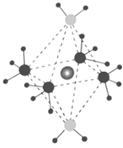 A、原子半径:Z>Y>X B、气态氢化物的稳定性:Y>Z C、加热时该离子首先失去的组分是X2Z D、两种配体中的键角:X2Z>YX310. 如图所示化合物是一种常见的储氢材料,其中 X、Y、Z为原子序数依次增大的短周期主族元素,且 X、Y、Z 处于不同周期。下列叙述错误的是( )
A、原子半径:Z>Y>X B、气态氢化物的稳定性:Y>Z C、加热时该离子首先失去的组分是X2Z D、两种配体中的键角:X2Z>YX310. 如图所示化合物是一种常见的储氢材料,其中 X、Y、Z为原子序数依次增大的短周期主族元素,且 X、Y、Z 处于不同周期。下列叙述错误的是( )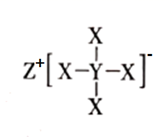 A、第一电离能:X>Y B、原子半径:Z>Y C、Y的最高价氧化物的水化物是一元强酸 D、Z与 X可形成离子化合物 ZX11. 叶腊石 是一种黏土矿物,广泛应用于陶瓷、冶金、建材等领域。 、 、 、 均为短周期元素,原子序数依次递增。 是地壳中含量最高的元素, 原子在元素周期表中的周期数等于族序数, 的简单阳离子与 含有相同的电子数, 原子最高能级和最低能级填充电子的数目相等,下列说法正确的是( )A、叶腊石中只含有离子键 B、第一电离能大小: C、工业上常用电解法制备元素 的单质 D、 的最高价氧化物的水化物可溶于 的最高价氧化物的水化物12. 如图为元素周期表中短周期的一部分,下列说法错误的是( )
A、第一电离能:X>Y B、原子半径:Z>Y C、Y的最高价氧化物的水化物是一元强酸 D、Z与 X可形成离子化合物 ZX11. 叶腊石 是一种黏土矿物,广泛应用于陶瓷、冶金、建材等领域。 、 、 、 均为短周期元素,原子序数依次递增。 是地壳中含量最高的元素, 原子在元素周期表中的周期数等于族序数, 的简单阳离子与 含有相同的电子数, 原子最高能级和最低能级填充电子的数目相等,下列说法正确的是( )A、叶腊石中只含有离子键 B、第一电离能大小: C、工业上常用电解法制备元素 的单质 D、 的最高价氧化物的水化物可溶于 的最高价氧化物的水化物12. 如图为元素周期表中短周期的一部分,下列说法错误的是( )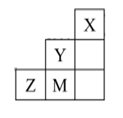 A、离子半径:M->Z2->Y- B、电负性:Y>M>Z C、简单气态氢化物的稳定性:Y>M>Z D、Y元素基态原子的简化电子排布式:[X]2s22p513. 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其结构示意图如下(实线代表共价键,其他重复单元的W、X未标注),W、X、Z分别位于不同周期,Z的原子半径在同周期中最大。下列说法错误的是( )
A、离子半径:M->Z2->Y- B、电负性:Y>M>Z C、简单气态氢化物的稳定性:Y>M>Z D、Y元素基态原子的简化电子排布式:[X]2s22p513. 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其结构示意图如下(实线代表共价键,其他重复单元的W、X未标注),W、X、Z分别位于不同周期,Z的原子半径在同周期中最大。下列说法错误的是( ) A、Y单质的氧化性在同族中最强 B、Z与Y可能组成多种离子化合物 C、Z的简单离子半径大于Y的简单离子 D、Y的气态氢化物热稳定性大于X的气态氢化物14. 现有甲、乙、丙、丁四种短周期元素,它们之间的关系如下:
A、Y单质的氧化性在同族中最强 B、Z与Y可能组成多种离子化合物 C、Z的简单离子半径大于Y的简单离子 D、Y的气态氢化物热稳定性大于X的气态氢化物14. 现有甲、乙、丙、丁四种短周期元素,它们之间的关系如下:Ⅰ.原子半径:甲<丙<乙<丁
Ⅱ.原子的最外层电子数:甲+丙=乙+丁=8
Ⅲ.原子的核外电子层数:丁>乙=丙=2甲
Ⅳ.乙元素的主要化合价:最高正价+最低负价=2
则下列说法错误的是( )
A、乙元素的最外层有5个电子,其氢化物含有极性键 B、四种元素中丙的非金属性最强,其最高价氧化物对应的含氧酸酸性最强 C、丁元素的氧化物对应的水化物与乙元素最高价氧化物对应水化物恰好完全反应形成的盐溶液显酸性 D、乙、丙两元素形成的简单氢化物稳定性丙的强于乙15. 原子序数依次增大的短周期元素 X、Y、Z、R,含 0.9%YR的水溶液称为生理盐水,X、Y、Z三种元素组成两种化合物 A、B 的性质如图,Z的质子数是X质子数的2 倍。下列说法正确的是( ) A、简单氢化物沸点 Z>X B、简单离子半径 X<Y<Z<R C、Y与X形成的一种化合物含有离子键和非极性键 D、化合物 A 和 B的水溶液皆呈中性16. X、Y、Z、W、R 是原子序数依次增大的短周期主族元素,Y 的同位素常用于判定古文物的年代,R 与 Y 位于同一主族,W 的电子层数与主族序数相同,X、Y、Z 组成的化合物甲的球棍模型如图所示,甲在疫情期间可用做消毒剂。下列说法正确的是( )
A、简单氢化物沸点 Z>X B、简单离子半径 X<Y<Z<R C、Y与X形成的一种化合物含有离子键和非极性键 D、化合物 A 和 B的水溶液皆呈中性16. X、Y、Z、W、R 是原子序数依次增大的短周期主族元素,Y 的同位素常用于判定古文物的年代,R 与 Y 位于同一主族,W 的电子层数与主族序数相同,X、Y、Z 组成的化合物甲的球棍模型如图所示,甲在疫情期间可用做消毒剂。下列说法正确的是( ) A、X 与 Y 只能形成两种二元化合物 B、最高价氧化物对应水化物的酸性:R>Y C、原子半径的大小关系:W>R>Z>Y>X D、化合物甲中存在极性共价键、非极性共价键,具有强氧化性17. 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z “组合”成一种超分子,具有高效的催化性能,其分子结构示意图如下,W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。下列说法正确的是(注:实线代表共价键,其他重复单元的 W、X未标注)( )
A、X 与 Y 只能形成两种二元化合物 B、最高价氧化物对应水化物的酸性:R>Y C、原子半径的大小关系:W>R>Z>Y>X D、化合物甲中存在极性共价键、非极性共价键,具有强氧化性17. 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z “组合”成一种超分子,具有高效的催化性能,其分子结构示意图如下,W、X、Z分别位于不同周期,Z是同周期中金属性最强的元素。下列说法正确的是(注:实线代表共价键,其他重复单元的 W、X未标注)( ) A、简单气态氢化物的热稳定性:X>Y B、简单离子半径:Y >Z C、W、Y、Z三种元素中组成的二元化合物只有两种离子化合物 D、该化合物中W、X、Y 都满足8电子稳定结构18. W、X、Y、Z是短周期元素。已知W单质是淡黄色固体,X单质是良好的半导体材料,Y原子最外层电子数是电子总数的2/3,Z是第三周期原子半径最小的金属元素。下列说法正确的是( )A、原子半径: B、气态氢化物的稳定性: C、电解Z的熔融氯化物可以制取Z单质 D、X和Z的最高价氧化物对应水化物均可溶于 溶液,故两者均是酸性氧化物19. 化合物A(如图所示)是一种常用的分析试剂,其中X、W、Z为同一短周期元素,W元素的L层有3个电子,Y元素的阴离子与 具有相同的核外电子层结构。下列叙述正确的是( )
A、简单气态氢化物的热稳定性:X>Y B、简单离子半径:Y >Z C、W、Y、Z三种元素中组成的二元化合物只有两种离子化合物 D、该化合物中W、X、Y 都满足8电子稳定结构18. W、X、Y、Z是短周期元素。已知W单质是淡黄色固体,X单质是良好的半导体材料,Y原子最外层电子数是电子总数的2/3,Z是第三周期原子半径最小的金属元素。下列说法正确的是( )A、原子半径: B、气态氢化物的稳定性: C、电解Z的熔融氯化物可以制取Z单质 D、X和Z的最高价氧化物对应水化物均可溶于 溶液,故两者均是酸性氧化物19. 化合物A(如图所示)是一种常用的分析试剂,其中X、W、Z为同一短周期元素,W元素的L层有3个电子,Y元素的阴离子与 具有相同的核外电子层结构。下列叙述正确的是( ) A、气态氢化物的稳定性: B、 的 溶液, C、原子半径大小: D、X元素最高价氧化物对应的水化物能与它的氢化物反应20. 第三周期元素 X、Y、Z、W的最高价氧化物分别溶于水可得四种溶液,浓度均为 0.01 mol·L-1的这四种溶液的 pH 与相应元素原子半径的关系如图所示。下列说法错误的是( )
A、气态氢化物的稳定性: B、 的 溶液, C、原子半径大小: D、X元素最高价氧化物对应的水化物能与它的氢化物反应20. 第三周期元素 X、Y、Z、W的最高价氧化物分别溶于水可得四种溶液,浓度均为 0.01 mol·L-1的这四种溶液的 pH 与相应元素原子半径的关系如图所示。下列说法错误的是( ) A、X、Y、Z、W 四种元素简单离子半径对应排序为 X<W<Z<Y B、简单阴离子的还原性:W>Z>Y C、W 元素的单质通入 Z元素气态氢化物的水溶液中可出现浑浊 D、Z的最高价氧化物对应的水化物和其气态氢化物在一定条件下可发生反应21. 主族元素Q、W、X、Y、Z的原子序数均不大于20。化合物ZW2与水剧烈反应,生成一种强碱和一种可燃性气体单质,Q与X同族,且X的最外层电子数是内层电子数的3倍,常温下,Y的单质能溶于Q的最高价氧化物对应的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是( )A、简单离子半径:Z>Q>X>Y B、工业上用电解相应氯化物冶炼Y单质 C、Q与X形成的化合物中,每个原子最外层均满足8电子结构 D、化合物ZW2中只含有离子键22. 短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子核内只有一个质子,Y原子最外层比W原子最外层多1个电子,Z的单质是空气中含量最高的气体,W的单质在常温下能被浓硫酸钝化。下列说法正确的是( )A、非金属性:X>Z B、简单离子半径:Z>W C、X、Y形成的化合物只含有极性键 D、Y的最高价氧化物对应水化物的酸性比Z的强23. W、X、Y、Z 是原子序数依次增大的短周期主族元素,W的氢化物水溶液能蚀刻玻璃,X、Y处于相邻位置,Y的最高正价与最低负价代数和为零,W、X 原子的最外层电子数之和与Y、Z 原子的最外层电子数之和相等。下列说法错误的是( )A、原子半径 : X > Y > Z > W B、最高正价:W > Z > Y > X C、简单氢化物的热稳定性:W > Z > Y D、简单离子的电子层结构: W与X相同
A、X、Y、Z、W 四种元素简单离子半径对应排序为 X<W<Z<Y B、简单阴离子的还原性:W>Z>Y C、W 元素的单质通入 Z元素气态氢化物的水溶液中可出现浑浊 D、Z的最高价氧化物对应的水化物和其气态氢化物在一定条件下可发生反应21. 主族元素Q、W、X、Y、Z的原子序数均不大于20。化合物ZW2与水剧烈反应,生成一种强碱和一种可燃性气体单质,Q与X同族,且X的最外层电子数是内层电子数的3倍,常温下,Y的单质能溶于Q的最高价氧化物对应的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是( )A、简单离子半径:Z>Q>X>Y B、工业上用电解相应氯化物冶炼Y单质 C、Q与X形成的化合物中,每个原子最外层均满足8电子结构 D、化合物ZW2中只含有离子键22. 短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子核内只有一个质子,Y原子最外层比W原子最外层多1个电子,Z的单质是空气中含量最高的气体,W的单质在常温下能被浓硫酸钝化。下列说法正确的是( )A、非金属性:X>Z B、简单离子半径:Z>W C、X、Y形成的化合物只含有极性键 D、Y的最高价氧化物对应水化物的酸性比Z的强23. W、X、Y、Z 是原子序数依次增大的短周期主族元素,W的氢化物水溶液能蚀刻玻璃,X、Y处于相邻位置,Y的最高正价与最低负价代数和为零,W、X 原子的最外层电子数之和与Y、Z 原子的最外层电子数之和相等。下列说法错误的是( )A、原子半径 : X > Y > Z > W B、最高正价:W > Z > Y > X C、简单氢化物的热稳定性:W > Z > Y D、简单离子的电子层结构: W与X相同二、多选题
-
24. 短周期元素X、Y、Z、Q、R的原子序数依次增大,且X、Y、Q、R的原子的最外层电子数之和为12。X与R同主族,Q是地壳中含量最高的元素。下列说法错误的是( )A、简单离子半径: Z>Q>R B、最简单氢化物的沸点:Y>Z>Q C、R的最高价氧化物对应的水化物为强碱 D、X、Z、Q三种元素可形成离子化合物和共价化合物
三、综合题
-
25. A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
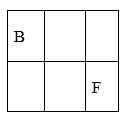 (1)、BF2的结构式为。(2)、D和F的氢化物中沸点较高的是(填化学式)。(3)、实验室制取G2气体的离子方程式为。(4)、在微电子工业中,C的最简单气态氢化物可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为。(5)、FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为。(6)、火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为。26. 已知A、B、C、D、E、F为前4周期的6种元素,原子序数依次增大,其中A位于周期表中s区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn , B和E同主族,D原子的最外层电子数是其内层电子数的3倍;F元素位于元素周期表的第4行、第11列。试回答下列问题:(1)、基态F原子的核外电子排布式为 。(2)、下列关于B2A2的说法中正确的是(填选项序号)
(1)、BF2的结构式为。(2)、D和F的氢化物中沸点较高的是(填化学式)。(3)、实验室制取G2气体的离子方程式为。(4)、在微电子工业中,C的最简单气态氢化物可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为。(5)、FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为。(6)、火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为。26. 已知A、B、C、D、E、F为前4周期的6种元素,原子序数依次增大,其中A位于周期表中s区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn , B和E同主族,D原子的最外层电子数是其内层电子数的3倍;F元素位于元素周期表的第4行、第11列。试回答下列问题:(1)、基态F原子的核外电子排布式为 。(2)、下列关于B2A2的说法中正确的是(填选项序号)①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中σ键和π键数目比为1:1
③B2A2是含极性键和非极性键的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)、B、C、D三种元素第一电离能由大到小的顺序为(用元素符号表示)。(4)、C的简单气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型有(填选项符号)①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)、基态E原子的最高能层具有的原子轨道数为;B和E的最高价氧化物中,熔沸点较高的是(写化学式)。(6)、F单质的晶体堆积方式为面心立方最密堆积(如下图),其配位数为 ;若F的相对原子质量为M,它的晶胞棱长为a cm,则F晶体的密度为g·cm-3 。(阿伏加德罗常数为NA)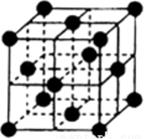 27. 物质A由原子序数依次增大的短周期元素X、Y、Z组成,其中Z为地壳含量最高的金属元素,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如下图所示:
27. 物质A由原子序数依次增大的短周期元素X、Y、Z组成,其中Z为地壳含量最高的金属元素,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如下图所示:回答下列问题:
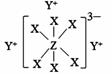 (1)、Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是 , 写出YX的电子式。(2)、比较X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)。(3)、在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式。28. 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]。(1)、Fe基态核外电子排布式为;[Fe(H2O)6]2+中与Fe2+配位的原子是(填元素符号)。(2)、NH3分子中氮原子的轨道杂化类型是;C、N、O元素的第一电离能由大到小的顺序为。(3)、与NH4+互为等电子体的一种分子为(填化学式)。(4)、柠檬酸的结构简式见图(
(1)、Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是 , 写出YX的电子式。(2)、比较X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示)。(3)、在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式。28. 以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]。(1)、Fe基态核外电子排布式为;[Fe(H2O)6]2+中与Fe2+配位的原子是(填元素符号)。(2)、NH3分子中氮原子的轨道杂化类型是;C、N、O元素的第一电离能由大到小的顺序为。(3)、与NH4+互为等电子体的一种分子为(填化学式)。(4)、柠檬酸的结构简式见图(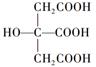 )。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为NA。 (5)、经X射线衍射测定发现,晶体铁在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于。若该堆积方式下的晶胞参数为a cm,则铁原子的半径为pm。
)。1 mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为NA。 (5)、经X射线衍射测定发现,晶体铁在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于。若该堆积方式下的晶胞参数为a cm,则铁原子的半径为pm。 29. 下表是元素周期表的一部分,其中每个数字序号代表一种元素。
29. 下表是元素周期表的一部分,其中每个数字序号代表一种元素。
请按要求回答下列问题
(1)、写出②的元素名称;(2)、元素的非金属性:⑥⑦(填“>”或“<”);(3)、上表8种元素中,金属性最强的元素是(填元素符号);(4)、⑦元素的最高价氧化物对应的水化物是(填化学式);(5)、③和④两元素形成的淡黄色固体物质含有的化学键的类型是;⑤和⑦两元素形成的简单化合物的电子式是;
(6)、元素③与⑥的简单氢化物中,沸点较低的是(填化学式);(7)、③、④、⑤简单离子的半径由大到小的顺序是 (填离子符号);(8)、①和②两元素形成分子的空间结构可能是(填字母)。
四、推断题
-
30. X、Y、L、M、N为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、M与N三种元素的质子数均为5的倍数,Y与L同主族。回答下列问题:(1)、X与M组成的最简单化合物的化学式是。(2)、X与N组成的物质是 (填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式是。(3)、Y在周期表中的位置是 , 其含氧酸的化学式是。(4)、M与N形成的化合物中M的化合价是。(5)、在25℃、101kPa下,已知13.5g的L固体单质在氧气中完全燃烧后恢复到原状态,放热419kJ,该反应的热化学方程式是。
-