2015-2016学年福建省宁德市高一上学期期末化学试卷
试卷更新日期:2016-08-22 类型:期末考试
一、选择题
-
1. 下列环境问题与CO2有关的是( )A、臭氧空洞 B、酸雨 C、光化学烟雾 D、温室效应2. 下列物质属于电解质的是( )A、铜 B、氯化钠 C、稀硫酸 D、酒精3. 胶体区别于其他分散系的本质特征是( )A、胶体的分散质能通过滤纸空隙,而浊液的分散质不能 B、胶体能产生丁达尔效应 C、胶体分散质粒子直径在1nm~100nm之间 D、胶体在一定条件下能稳定存在4. 下列变化中不属于氮的固定的是( )A、打雷闪电时,大气中产生了NO B、豆科植物的根瘤菌把空气中的氮气转化为硝酸盐等含氮化合物 C、N2和H2在一定条件下反应生成NH3 D、NH3经催化氧化生成NO5. 下列物质中,不能通过单质直接化合生成的是( )A、HCl B、MgO C、SO3 D、CO26. 下列有关氧化还原反应的叙述正确的是( )A、置换反应一定属于氧化还原反应 B、在反应中一定有沉淀、气体或水生成 C、肯定有一种元素被氧化,另一种元素被还原 D、分解反应和复分解反应有可能是氧化还原反应7. 用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作.下列图示对应的操作规范的是( )A、
 称量
B、
称量
B、 溶解
C、
溶解
C、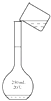 转移
D、
转移
D、 定容
8. 下列叙述正确的是( )A、1molN2的质量为28gmol﹣1 B、3.01×1023个SO2分子的质量为32g C、Cl2的摩尔质量为71g D、标准状况下1mol任何物质的体积均为22.4L9. 下列各组物质不属于同素异形体的是( )A、CO,CO2 B、O2、O3 C、红磷、白磷 D、金刚石、石墨10. 下列物质在水中的电离方程式错误的是( )A、MgSO4=Mg2++SO B、Ba(OH)2=Ba2++OH2﹣ C、NaHCO3=Na++HCO D、H2SO4=2H++SO11. 下列溶液中,Cl﹣离子浓度最大的是( )A、0.5mol•L﹣1HCl溶液 B、1mol•L﹣1MgCl2溶液 C、2mol•L﹣1NaCl溶液 D、1mol•L﹣1FeCl3溶液12. 下列反应的离子方程式正确的是( )A、CO2通入足量氢氧化钠溶液中:CO2+2OH﹣=CO +H2O B、用小苏打治疗胃酸过多: +OH﹣=CO2↑+H2O C、将Cl2通入水中:Cl2+H2O=Cl﹣+2H++ClO﹣ D、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+13. 实验室保存下列物质的方法中,不正确的是( )A、少量金属钠保存在煤油里 B、浓硫酸存放在广口试剂瓶中 C、FeSO4溶液存放在加有少量铁粉的试剂瓶中 D、氯水应装在棕色细口瓶中密封避光保存14. 下列溶液中能大量共存的一组离子是( )A、Ba2+、K+、Na+、SO B、Na+、H+、OH﹣、Cl﹣ C、Mg2+、K+、Cl﹣、NO D、Ca2+、K+、CO 、SO15. 从海水中提取镁涉及到的化学反应有:①CaO+H2O=Ca(OH)2、②Mg2++2OH﹣=Mg(OH)2↓、③Mg(OH)2+2HCl=MgCl2+2H2O、④MgCl2 Mg+Cl2↑没有涉及到的反应类型是( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应16. 下列说法不正确的是( )A、实验室用Ca(OH)2固体和NH4Cl固体共热制NH3 B、常温下铁遇浓硝酸钝化,常温下可用铁罐储存浓硝酸 C、向蔗糖中滴入浓硫酸后变黑,体现了浓硫酸的脱水性 D、FeCl2溶液中滴入KSCN溶液,溶液变红
定容
8. 下列叙述正确的是( )A、1molN2的质量为28gmol﹣1 B、3.01×1023个SO2分子的质量为32g C、Cl2的摩尔质量为71g D、标准状况下1mol任何物质的体积均为22.4L9. 下列各组物质不属于同素异形体的是( )A、CO,CO2 B、O2、O3 C、红磷、白磷 D、金刚石、石墨10. 下列物质在水中的电离方程式错误的是( )A、MgSO4=Mg2++SO B、Ba(OH)2=Ba2++OH2﹣ C、NaHCO3=Na++HCO D、H2SO4=2H++SO11. 下列溶液中,Cl﹣离子浓度最大的是( )A、0.5mol•L﹣1HCl溶液 B、1mol•L﹣1MgCl2溶液 C、2mol•L﹣1NaCl溶液 D、1mol•L﹣1FeCl3溶液12. 下列反应的离子方程式正确的是( )A、CO2通入足量氢氧化钠溶液中:CO2+2OH﹣=CO +H2O B、用小苏打治疗胃酸过多: +OH﹣=CO2↑+H2O C、将Cl2通入水中:Cl2+H2O=Cl﹣+2H++ClO﹣ D、用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+13. 实验室保存下列物质的方法中,不正确的是( )A、少量金属钠保存在煤油里 B、浓硫酸存放在广口试剂瓶中 C、FeSO4溶液存放在加有少量铁粉的试剂瓶中 D、氯水应装在棕色细口瓶中密封避光保存14. 下列溶液中能大量共存的一组离子是( )A、Ba2+、K+、Na+、SO B、Na+、H+、OH﹣、Cl﹣ C、Mg2+、K+、Cl﹣、NO D、Ca2+、K+、CO 、SO15. 从海水中提取镁涉及到的化学反应有:①CaO+H2O=Ca(OH)2、②Mg2++2OH﹣=Mg(OH)2↓、③Mg(OH)2+2HCl=MgCl2+2H2O、④MgCl2 Mg+Cl2↑没有涉及到的反应类型是( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应16. 下列说法不正确的是( )A、实验室用Ca(OH)2固体和NH4Cl固体共热制NH3 B、常温下铁遇浓硝酸钝化,常温下可用铁罐储存浓硝酸 C、向蔗糖中滴入浓硫酸后变黑,体现了浓硫酸的脱水性 D、FeCl2溶液中滴入KSCN溶液,溶液变红二、解答题
-
17. A、B、C、D是中学化学常见的物质,它们之间的相互转化关系如下(部分反应条件及产物略去).
 (1)、若A为黄色非金属固体单质,则A的名称是 , B通入品红溶液观察到的现象是 .(2)、若A为活动金属单质,D是强碱,则A与水反应的离子方程式为 .(3)、已知:C为红棕色气体
(1)、若A为黄色非金属固体单质,则A的名称是 , B通入品红溶液观察到的现象是 .(2)、若A为活动金属单质,D是强碱,则A与水反应的离子方程式为 .(3)、已知:C为红棕色气体①若A是非金属单质气体,是空气的主要成分之一,试写出D的稀溶液与铜反应的化学方程式 .
②若A是常见无色有刺激性气味的碱性气体,则A的化学式为 , 写出A的一种用途 .
18. 某研究小组利用含硫酸铜的工业废液制备硫酸铵,流程如下: (1)、操作Ⅰ的名称为 , 滤渣的成分为 .(2)、工业废液中加入过量铁粉所发生反应的离子方程式为 .(3)、操作Ⅱ得到的(NH4)2SO4溶液进行蒸发浓缩,需要的仪器除了酒精灯、铁架台、蒸发皿外,还需要 .(4)、如图溶液A中发生反应的离子方程式为4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3↓
(1)、操作Ⅰ的名称为 , 滤渣的成分为 .(2)、工业废液中加入过量铁粉所发生反应的离子方程式为 .(3)、操作Ⅱ得到的(NH4)2SO4溶液进行蒸发浓缩,需要的仪器除了酒精灯、铁架台、蒸发皿外,还需要 .(4)、如图溶液A中发生反应的离子方程式为4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3↓该反应是否为氧化还原反应(填“是”或“否”).
(5)、检验(NH4)2SO4溶液中含有SO 的方法为 .19. 如表是甲同学研究氯水性质实验片段的活动记录.实验内容
实验现象
解释及结论
观察氯水的颜色、状态
呈黄绿色
①
向氯水中滴入几滴硝酸银溶液
有白色沉淀
②
用玻璃棒蘸取氯水,点在蓝色石蕊试纸上
滴有氯水的试纸中间变白,外圈变红
③
(1)、根据上述实验内容和现象,选择合理解释填到表中(填序号)A.氯化中存在Cl﹣
B.氯水中有漂白性物质和酸性物质
C.氯水中存在Cl2分子
(2)、甲同学在实验中运用了 进行探究(填序号)A、观察法 B、比较法 C、分类法 D、实验法(3)、乙同学在甲同学的实验基础上设计了如图实验装置进一步研究氯气的性质.
回答下列问题:
①实验中,乙同学观察到干燥的有色布条不褪色,湿润的有色布条褪色,得出的实验结论是 .
②为了防止多余的氯气污染空气,实验室常用X溶液来吸收尾气,写出X的化学式 .