高中化学人教版必修1 第一章第二节 化学计量在实验中的应用
试卷更新日期:2020-07-31 类型:同步测试
一、单选题
-
1. 下列说法正确的是A、摩尔是国际单位制中7个基本物理量之一 B、阿伏加德罗常数等于6.02×1023个12C中含有的碳原子数 C、物质的量是能把物质的质量和微观粒子数联系起来的一个物理量 D、若一分子NO、N2O的质量分别为ag、bg,则N原子的摩尔质量是(b-a) g/mol2. 2V L Fe2(SO4)3溶液中含有a g SO42- , 取此溶液V L,用水稀释至2V L,则稀释后溶液中Fe3+的物质的量浓度为( )
A、 mol·L-1 B、 mol·L-1 C、 mol·L-1 D、 mol·L-13. 已知某元素的阳离子R+的核内中子数为n,质量数为A。则mg它的氧化物中所含电子的物质的量为( )A、 (A-n+8)mol B、 (A-n+10)mol C、 (A-n+4)mol D、 (A-n+8)mol4. 下列实验能达到实验目的的是 ( )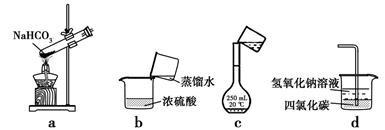 A、用装置a加热分解NaHCO3固体 B、按装置b把浓硫酸稀释为稀硫酸 C、按装置c把溶液转移入容量瓶 D、用装置d吸收尾气中的氯气与氯化氢5. 设NA表示阿伏加德岁常数,下列叙述中正确的是( )A、常温常压下,11.2L二氧化碳含有的原子数等于1.5NA B、标准状况下,22.4L酒精中所含分了数为NA C、标准状况下,18g水所含原子数为NA D、常温常压下,48gO2与O3混合物含有的氧原子数为3NA6. 下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量可忽略不计)。其中能表示等质量的氢气与氦气的是( )A、
A、用装置a加热分解NaHCO3固体 B、按装置b把浓硫酸稀释为稀硫酸 C、按装置c把溶液转移入容量瓶 D、用装置d吸收尾气中的氯气与氯化氢5. 设NA表示阿伏加德岁常数,下列叙述中正确的是( )A、常温常压下,11.2L二氧化碳含有的原子数等于1.5NA B、标准状况下,22.4L酒精中所含分了数为NA C、标准状况下,18g水所含原子数为NA D、常温常压下,48gO2与O3混合物含有的氧原子数为3NA6. 下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量可忽略不计)。其中能表示等质量的氢气与氦气的是( )A、 B、
B、 C、
C、 D、
D、 7. 某一Na2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.5mol/L,SO42-的物质的量浓度为0.8 mol/L,则此溶液中Na+的物质的量浓度为( )A、0.1mol/L B、0.15 mol/L C、0.2 mol/L D、0.25 mol/L8. 标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示错误的是( )A、体积:④<①<②<③ B、密度:①<④<③<② C、质量:④<①<③<② D、氢原子数:②<④<③<①9. 已知0.4mol的X气体分子的质量为6.4g,则X气体的摩尔质量是( )A、16g B、32 C、16g/mol D、64g/mol10. 某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为( )A、1∶2 B、1∶4 C、3∶4 D、3∶211. 下列溶液中的c (Cl-) 与50mL 1mol·L-1 氯化铝溶液中的c (Cl-)相等的是( )A、150mL 3mol·L-1 氯化钾溶液 B、75mL 2mol·L-1 氯化铵溶液 C、150mL1mol·L-1 氯化钠溶液 D、75mL 1mol·L-1 氯化钡溶液12. 质量相等的SO2和SO3 , 所含氧原子数之比为( )A、1:1 B、2:3 C、6:5 D、5:613. 欲配制100mL 1.0 mol/L Na2CO3溶液,正确的方法是( )
7. 某一Na2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.5mol/L,SO42-的物质的量浓度为0.8 mol/L,则此溶液中Na+的物质的量浓度为( )A、0.1mol/L B、0.15 mol/L C、0.2 mol/L D、0.25 mol/L8. 标准状况下有①6.72L甲烷②3.01×1023个氯化氢分子③13.6 g硫化氢④0.2 mol NH3。下列对这四种气体的关系从小到大表示错误的是( )A、体积:④<①<②<③ B、密度:①<④<③<② C、质量:④<①<③<② D、氢原子数:②<④<③<①9. 已知0.4mol的X气体分子的质量为6.4g,则X气体的摩尔质量是( )A、16g B、32 C、16g/mol D、64g/mol10. 某溶液中只含有Na+、Al3+、Cl-、SO42- 四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为( )A、1∶2 B、1∶4 C、3∶4 D、3∶211. 下列溶液中的c (Cl-) 与50mL 1mol·L-1 氯化铝溶液中的c (Cl-)相等的是( )A、150mL 3mol·L-1 氯化钾溶液 B、75mL 2mol·L-1 氯化铵溶液 C、150mL1mol·L-1 氯化钠溶液 D、75mL 1mol·L-1 氯化钡溶液12. 质量相等的SO2和SO3 , 所含氧原子数之比为( )A、1:1 B、2:3 C、6:5 D、5:613. 欲配制100mL 1.0 mol/L Na2CO3溶液,正确的方法是( )① 将10.6 g Na2CO3 溶于100mL水中
② 将28.6g Na2CO3·10H2O溶于水配成100 mL溶液
③ 将20 mL 5.0 mol/L Na2CO3溶液加水稀释至100 mL
A、①②③ B、②③ C、只有② D、只有③二、实验探究题
-
14. 用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:(1)、配制稀盐酸时,应选用容量为mL的容量瓶。(2)、经计算需要mL浓盐酸,在量取时宜选用下列量筒中的。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)、在量取浓盐酸后,进行了下列操作:①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)。其中②中的操作中。处填“改用。”
(4)、使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会影响所配溶液的浓度(填“偏高”、“偏低”或“无影响”)①用天平(不使用游码)称量时,被称量物与砝码的位置放颠倒了
②用量筒量取液体溶质,读数时俯视量筒,所配溶液的浓度
③用胶头滴管定容时,仰视刻度线,所配溶液的浓度
三、综合题
-
15. 6.4gO2的物质的量是多少?含有多少个氧气分子?在标准状况下的体积是多少?16. 填写下列空白:(1)、15.8g KMnO4的物质的量是 , 所含原子数目为 , 其所含氧元素与molNaClO中所含氧元素的质量相同。(2)、相同条件下,相同质量的Al(OH)3和Na2O2中氧原子的个数比是;相同物质的量的NH4+与OH-所含电子个数之比为。17.(1)、已知质量分数为98%的硫酸密度为1.84g•cm﹣3 . 用此硫酸配制2mol•L﹣1H2SO4溶液500mL,需要用量筒量取mL98%的硫酸。(2)、现将56.9g镀锌铁皮放入一定量2mol•L﹣1H2SO4溶液中,至完全溶解,并收集到氢气22.4L(标准状况),试求镀锌铁皮中Zn的质量分数。(写出计算过程,结果精确到0.1%)18.(1)、3.01×1023个氯气分子的物质的量是 , 氯原子的物质的量是。(2)、1.5molNa2SO4·10H2O中所含的Na+的物质的量是 , 所含的SO42-的物质的量是 , 所含H2O的数目是。(3)、一定量的Na2CO3中,碳原子和氧原子的物质的量之比为。(4)、12.4gNa2R含0.4molNa+ , 则Na2R的摩尔质量为 , R的相对原子质量为。含R的质量为1.6g的Na2R,其物质的量为。
-