浙江省杭州地区七校2019-2020学年高二上学期理综-化学期中考试试卷
试卷更新日期:2019-11-18 类型:期中考试
一、选择题(每题2分,共18分。)
-
1. 2019年4月杭州环保监测中心研判,杭州地区空气质量明显改善,环保中心提出开发利用可再生能源,建设美好家园,下列属于可再生能源的是( )
①天然气 ②生物质能 ③地热能 ④石油 ⑤太阳能 ⑥潮汐能 ⑦风能 ⑧氢能
A、 ①②③④ B、②③⑤⑥⑦⑧ C、④⑤⑥⑦⑧ D、①②③⑤⑥⑦⑧2. 某可逆反应已建立了化学平衡,当改变条件使平衡正向移动时,下列叙述正确的是( )①生成物的质量分数一定增加 ② 任一生成物总量一定增加 ③反应物的转化率一定增大 ④反应物的浓度一定降低 ⑤正反应速率一定大于逆反应速率
A、②⑤ B、②③⑤ C、①②④ D、②④⑤3. 将4molA气体和2molB气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)⇌2C(g),若经2s后测得C的浓度为
0.6mol•L-1 , 现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol•L-1•s-1
②用物质B表示的反应的平均速率为0.6mol•L-1•s-1
③2s时物质A的转化率为70%④2s时物质B的浓度为0.7mol•L-1
其中正确的是( )
A、①③ B、①④ C、②③ D、③④4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径比Y的小,X与W同主族,Y、Z族序数之和为11,Z原子最外层电子数是内层电子总数的3倍.下列说法不正确的是( )A、元素Z、W的简单离子的电子层结构相同 B、元素Y的简单气态氢化物的热稳定性比Z的弱 C、W、Z两种元素形成的化合物肯定是离子化合物 D、由X、Y、Z三种元素形成化合物,其水溶液肯定显酸性5. 下列说法正确的是( )A、6g碳和12gO2反应放出6akJ热量,则碳的热值为akJ•g-1 B、在稀溶液中,H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ•mol-1 , 若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量等于57.3kJ C、由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s)△H<0 D、已知:298K时,N2(g)+3H2(g)⇌2NH3(g)△H=-92.0kJ•mol-1,在相同温度下,向密闭容器中通入0.5molN2和1.5molH2 , 充分反应放出46.0kJ的热量6. 下列是有关实验的叙述中,合理的是( )①用pH试纸测得氯水的pH为2 ②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需要的浓度
A、②④⑥ B、②③⑥ C、①②④ D、②③④⑤⑥7. 下列说法不正确的是( )A、门捷列夫根据元素的性质随着相对原子质量递增呈现周期性变化规律,制出了第一张元素周期律 B、侯氏制碱法的原理是将CO2通入氨的NaCl饱和溶液中,使NaHCO3析出,NaHCO3受热分解生成Na2CO3 , NaHCO3和Na2CO3在食品工业上都有着广泛的应用 C、石灰乳与海水混合,过滤得Mg(OH)2 , 将其溶于盐酸,再蒸发结晶得到MgCl2 , 电解熔融MgCl2可得到金属镁 D、工业炼铁、从海水中提取镁、制玻璃、水泥过程中都需要用到石灰石8. 下列关于pH=2的盐酸和0.01mol/L的醋酸,说法不正确的是( )A、中和相同体积的两种酸溶液所需NaOH的物质的量相同 B、醋酸溶液的浓度等于盐酸 C、两种溶液中由水电离出来的c(H+)不相同 D、分别用蒸馏水稀释相同倍数后,盐酸的pH大于醋酸的pH9. 我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意如下:则下列说法不正确的是( )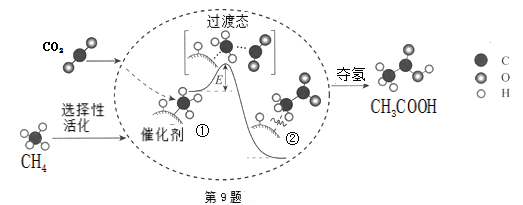 A、生成CH3COOH总反应是化合反应 B、①→②吸收能量 C、CH4→CH3COOH过程中,有C-H键发生断裂 D、①→②过程形成了C-C键10. 用NA表示阿伏加德罗常数,下列叙述不正确的是( )A、9g克13CO2与N217O的混合物中所含中子数为4.6NA B、7.8克Na2O2中含有离子数为0.3NA C、50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA D、5.6克铁与标况下2.24L氯气充分反应,转移电子数为0.2NA11. 为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图1、图2所示的实验。下列叙述中不正确的是 ( )
A、生成CH3COOH总反应是化合反应 B、①→②吸收能量 C、CH4→CH3COOH过程中,有C-H键发生断裂 D、①→②过程形成了C-C键10. 用NA表示阿伏加德罗常数,下列叙述不正确的是( )A、9g克13CO2与N217O的混合物中所含中子数为4.6NA B、7.8克Na2O2中含有离子数为0.3NA C、50 mL 12 mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA D、5.6克铁与标况下2.24L氯气充分反应,转移电子数为0.2NA11. 为探究Fe3+和Cu2+对H2O2分解反应的催化效果,某同学分别设计了图1、图2所示的实验。下列叙述中不正确的是 ( )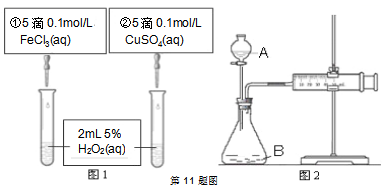 A、图2中的A为分液漏斗 B、图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率 C、若图1实验中反应速率为①>②,则Fe3+对H2O2分解的催化效果一定比Cu2+好 D、图1实验可通过观察产生气泡的快慢来比较反应速率12. 下列实验现象及相关的离子方程式均正确的是( )A、Cl2与FeI2溶液反应,当n(Cl2):n(FeI2)=1:1时,2Fe2++2I-+2Cl2
A、图2中的A为分液漏斗 B、图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率 C、若图1实验中反应速率为①>②,则Fe3+对H2O2分解的催化效果一定比Cu2+好 D、图1实验可通过观察产生气泡的快慢来比较反应速率12. 下列实验现象及相关的离子方程式均正确的是( )A、Cl2与FeI2溶液反应,当n(Cl2):n(FeI2)=1:1时,2Fe2++2I-+2Cl2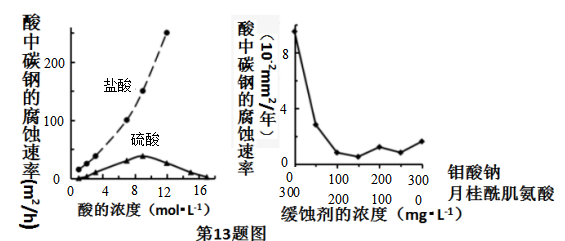 A、盐酸的浓度越大,腐蚀速率越快 B、碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比 C、钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小 D、对比盐酸和硫酸两条曲线,可知Cl-也可能会影响碳素钢的腐蚀速率14. 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,不正确的是( )
A、盐酸的浓度越大,腐蚀速率越快 B、碳素钢的腐蚀速率不随硫酸的浓度增大而增大,说明反应速率不与c(H+)成正比 C、钼酸钠和月桂酰肌氨酸的浓度相等时,腐蚀速率最小 D、对比盐酸和硫酸两条曲线,可知Cl-也可能会影响碳素钢的腐蚀速率14. 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,不正确的是( )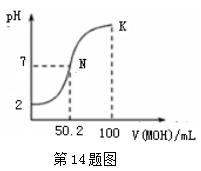 A、HA的电离方程式为:HA=H++A- B、MOH为一元弱碱 C、K点对应的溶液中有:c(MOH)+c(M+)=0.02mol
A、HA的电离方程式为:HA=H++A- B、MOH为一元弱碱 C、K点对应的溶液中有:c(MOH)+c(M+)=0.02mol L-1
D、N点对应的溶液中有:c(M+)=c(A-)
15. 2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如图所示:下列说法正确的是( )
L-1
D、N点对应的溶液中有:c(M+)=c(A-)
15. 2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如图所示:下列说法正确的是( )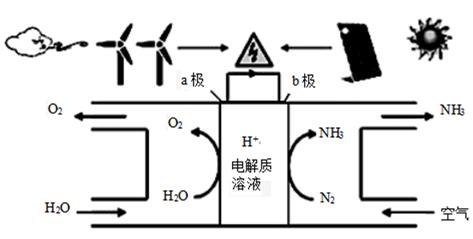 A、 图中能量转化方式只有2种 B、H+向a极区移动 C、b极发生的电极反应为:N2+6H++6e-=2NH3 D、a极上每产生22.4LO2流过电极的电子数一定为4×6.02×102316. 2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的( )
A、 图中能量转化方式只有2种 B、H+向a极区移动 C、b极发生的电极反应为:N2+6H++6e-=2NH3 D、a极上每产生22.4LO2流过电极的电子数一定为4×6.02×102316. 2mol金属钠和1mol氯气反应的能量关系如图所示,下列说法不正确的( )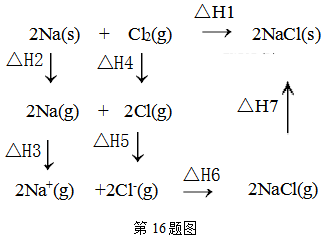 A、△H2+△H3+△H4+△H5+△H6+△H7=△H1 B、△H4的值数值上和Cl-Cl共价键的键能相等 C、△H5<0,在相同条件下,2Br(g)的△H5′<△H5 D、△H7<0,且该过程形成离子键17. 根据如下能量关系示意图,下列说法正确的是( )
A、△H2+△H3+△H4+△H5+△H6+△H7=△H1 B、△H4的值数值上和Cl-Cl共价键的键能相等 C、△H5<0,在相同条件下,2Br(g)的△H5′<△H5 D、△H7<0,且该过程形成离子键17. 根据如下能量关系示意图,下列说法正确的是( )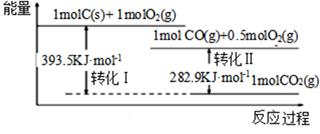 A、1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ B、反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量大于反应物的总能量 C、由C→CO的热化学方程式为:2C(s)+O2(g) =2CO(g) ΔH= −221.2 kJ∙mol−1 D、热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= −10.1 kJ∙mol−118. 常温下,有pH=1的某溶液中可能含有Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的某几种,现取100mL该溶液进行如下是实验:根据实验结果,下列判断正确的是( )
A、1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ B、反应2CO(g)+O2(g) =2CO2(g)中,生成物的总能量大于反应物的总能量 C、由C→CO的热化学方程式为:2C(s)+O2(g) =2CO(g) ΔH= −221.2 kJ∙mol−1 D、热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= −10.1 kJ∙mol−118. 常温下,有pH=1的某溶液中可能含有Na+、Fe3+、Fe2+、I-、Cl-、CO32-中的某几种,现取100mL该溶液进行如下是实验:根据实验结果,下列判断正确的是( )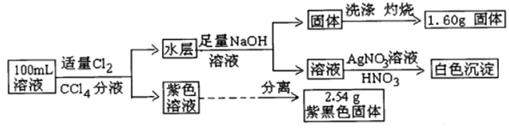 A、Fe2+ , I- , Cl-三种离子一定存在 B、不能确定Na+和Cl-是否存在,CO32-一定不存在 C、Fe3+与Fe2+至少有一种 D、该溶液中C(Cl-)≥0.1mol∙L-1
A、Fe2+ , I- , Cl-三种离子一定存在 B、不能确定Na+和Cl-是否存在,CO32-一定不存在 C、Fe3+与Fe2+至少有一种 D、该溶液中C(Cl-)≥0.1mol∙L-1二、填空简答题(本大题包括6小题,共55分。)
-
19. A,B,C,D,E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍。A的一种原子中,质量数与质子数之差为零。D元素原子的最外层电子数为m,次外层电子数为n。E元素原子的L层上电子数为(m+n),M层上电子数为 。请回答下列
问题:
(1)、B元素是(填元素名称)D元素在周期表中的位置是(2)、C与E形成的化合物E3C属于(填“原子”“离子”或“分子”)晶体。(3)、由A,D,E元素组成的化合物中存在的化学键类型是(4)、写出一个E和D形成的化合物与水发生氧化还原反应的离子方程式:(5)、已知:甲+H2O→丙+丁,该反应不是氧化还原反应。若甲是由N和Cl元素组成的化合物,其分子结构模型如下图所示,丁与H2O有相同的电子总数,则丙的电子式为
 (6)、与D同主族且上下相邻的元素M、N,原子电子层数M>N>D,三种元素的氢化物的沸点由大到小的顺序是(填化学式)20. 现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(6)、与D同主族且上下相邻的元素M、N,原子电子层数M>N>D,三种元素的氢化物的沸点由大到小的顺序是(填化学式)20. 现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。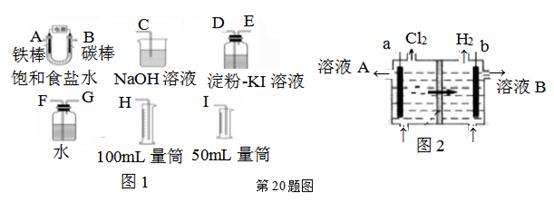 (1)、试从上图图1中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接 , B接。(2)、铁棒接直流电源的极;碳棒上发生的电极反应为。(3)、能说明氯气具有氧化性的实验现象是。(4)、假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6 mL(已折算成标准状况)时,溶液的pH为。(5)、工业上采用离子交换膜法电解饱和食盐水,如上图图2,该离子交换膜是(填“阳离子”或“阴离子”)交换膜,溶液A是(填溶质的化学式)21. 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”。引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气。
(1)、试从上图图1中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接 , B接。(2)、铁棒接直流电源的极;碳棒上发生的电极反应为。(3)、能说明氯气具有氧化性的实验现象是。(4)、假定装入的饱和食盐水为50 mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6 mL(已折算成标准状况)时,溶液的pH为。(5)、工业上采用离子交换膜法电解饱和食盐水,如上图图2,该离子交换膜是(填“阳离子”或“阴离子”)交换膜,溶液A是(填溶质的化学式)21. 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”。引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气。I、用NH3催化还原NOx可以消除氮氧化物的污染。反应原理为:NO(g)+NO2(g)+2NH3(g) 2N2(g)+3H2O(g)。
(1)、该反应的△S0(填“>”、“=”或“<”)。(2)、II、已知反应N2O4(g) 2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有。
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变
(3)、III、用CH4催化还原NOx也可以消除氮氧化物的污染。已知:CH4(g)的标准燃烧热为-890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=﹣1114 kJ/mol
2NO(g)+O2(g)=2NO2(g) △H=﹣114 kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:。
(4)、在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表: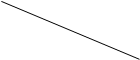 时间/min
时间/min温度/℃
0
10
20
40
50
T1
1.2
0.9
0.7
0.4
0.4
T2
1.2
0.8
0.56
…
0.5
①温度为T1℃时,0~20min内,v(CH4)=。
②温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 达新平衡时CH4的转化率将(填“增大”、“减小”或“不变”)。
22. 过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图1为1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图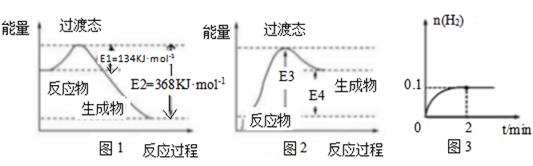
(1)、试写出NO2和CO反应的热化学方程式:(2)、在密闭容器中进行的上述反应是可逆反应,图2是某学生模仿图1画出的NO+CO2 =NO2+CO的能量变化示意图。则图中E3=kJ•mol-1(3)、在密闭容器中充入1molH2和1molI2 , 压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)⇌2HI(g)△H<0.保持容器内气体压强不变,向其中加入1molN2 , 反应速率(填“变大”、“变小”或“不变”),平衡移动(填“向正反应方向”、“向逆反应方向”或“不”)。(4)、T℃,向1L密闭容器中加入1molHI(g),发生反应2HI⇌H2+I2 , H2物质的量随时间的变化如图3所示。①该温度下,2HI(g)⇌H2(g)+I2(g)的平衡常数K=
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则
是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
23. 黄铁矿(主要成分FeS2)是工业制硫酸的主要原料,暴露在空气中会被缓慢氧化,其氧化过程如图所示。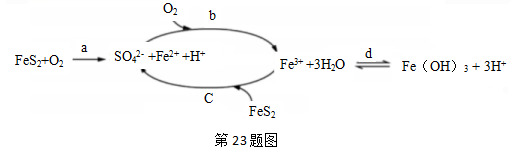 (1)、写出a步骤离子方程式(2)、如何检验b步骤反应后的溶液中含Fe2+(3)、取10mLb步骤反应后的溶液测定其成分,通入标准状况下Cl222.4mL恰好完全反应。然后调节pH,使溶液中的铁元算全部转化为沉淀,经过滤、洗涤、灼烧,冷却后称重,得固体质量为0.32g,则该溶液中c(Fe3+)=(写出计算推理过程)24. 次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性。回答下列问题:(1)、H3PO2及NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
(1)、写出a步骤离子方程式(2)、如何检验b步骤反应后的溶液中含Fe2+(3)、取10mLb步骤反应后的溶液测定其成分,通入标准状况下Cl222.4mL恰好完全反应。然后调节pH,使溶液中的铁元算全部转化为沉淀,经过滤、洗涤、灼烧,冷却后称重,得固体质量为0.32g,则该溶液中c(Fe3+)=(写出计算推理过程)24. 次磷酸(H3PO2)是一种精细化工产品,是一元中强酸,具有较强还原性。回答下列问题:(1)、H3PO2及NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。①在H3PO2中,磷元素的化合价为在酸性环境中,利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:(填化学式)。
②NaH2PO2是(填“正盐”或“酸式盐”),其溶液中离子浓度由大到小的顺序应为
(2)、次磷酸(H3PO2)可以通过电解的方法制备.工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):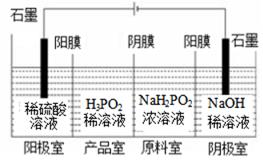
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因(结合一定的文字分析)