2019年高考化学模拟题
试卷更新日期:2018-11-29 类型:高考模拟
一、单选题
-
1. 我国有着悠久的历史传统文化。下列有关古诗词(句)中蕴含的化学知识分析正确的是( )A、“千淘万漉虽辛苦,吹尽狂沙始到金”,说明金在自然界中以游离态存在,其化学性质稳定 B、“春蚕到死丝方尽,蜡炸成灰泪始干”,其中只有化学变化的过程 C、“纷纷灿烂如星陨,赫赫喧虺似火攻。”,灿烂的烟花是某些金属的焰色反应,属于化学变化 D、“粉身碎骨浑不怕,要留清白在人间”,其中发生的主要化学反应均为氧化还原反应2. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA B、标准状况下,2.24LSO3中所含原子数为0.4 NA C、常温常压下,16gO2和O3的混合气体中所含原子数目为NA D、在一定条件下1molN2与3molH2反应生成的NH3分子数为2NA3. 下列说法中正确的是( )A、石油液化气、汽油、地沟油加工制成的生物柴油都是碳氢化合物 B、铜盐有毒,主要是因为铜离子能与蛋白质反应,使蛋白质变性 C、聚乙烯塑料可用于食品包装,该塑料的老化是因为发生加成反应 D、医用酒精和葡萄糖注射液可用丁达尔效应区分4. 短周期元素A、B、C、D、E、F原子序数依次增大。B、F的原子最外层电子数均是其周期序数的2倍,A、C可形成10电子分子R,R物质是常见的无机溶剂。D为短周期主族元素中原子半径最大的元素,同周期元素的简单离子中E元素的离子半径最小。下列说法正确的是( )A、由A,C,D形成的化合物只含有离子键 B、A,B,C形成的化合物均可溶于水 C、C,F的气态氢化物稳定性:C<F D、D,E,F的最高价氧化物对应水化物两两之间可发生反应5. 下列实验操作、实验现象和实验结论均正确的是( )
选项
实验操作
实验现象
实验结论
A
向待测溶液中先滴加几滴氯水,然后滴加KSCN溶液
溶液变红
待测溶液中含有Fe2+
B
向KMnO4酸性溶液中滴加乙二酸
溶液褪色
乙二酸具有还原性
C
向AgNO3溶液中滴加过量氨水
得到澄清溶液
Ag+与NH3·H2O能大
量共存
D
向10mL0.1mol·L-1Na2S溶液中滴入2mL0.1 mol·L-1ZnSO4溶液,再加入0.1 mol·L-1CuSO4溶液
开始有白色沉淀生成;后有黑色沉淀生成
Ksp(CuS)<Ksp(ZnS)
A、A B、B C、C D、D6. 常温下,向100mL0.1mol/LNH4Cl溶液中,逐滴滴加0.1mol/L NaOH溶液。NH4+和NH3·H2O的变化趋势如图所示(不考虑NH3的逸出)。下列说法正确的是( )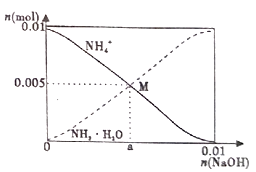 A、M点溶液中水的电离程度比原溶液大 B、在M点时,n(H+)-n(OH-)=(0.005-a)mol C、随着NaOH溶液的滴加, 不断增大 D、当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)7. 摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2+6C Li1-xCoO2+LixC6。示意图如右。下列说法正确的是( )
A、M点溶液中水的电离程度比原溶液大 B、在M点时,n(H+)-n(OH-)=(0.005-a)mol C、随着NaOH溶液的滴加, 不断增大 D、当n(NaOH)=0.01mol时,c(NH3·H2O)>c(Na+)>c(OH-)7. 摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2+6C Li1-xCoO2+LixC6。示意图如右。下列说法正确的是( ) A、充电时,阳极的电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2 B、该装置工作时涉及到的能量形式有3种 C、充电时锂离子由右向左移动 D、放电时,正极质量增加
A、充电时,阳极的电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2 B、该装置工作时涉及到的能量形式有3种 C、充电时锂离子由右向左移动 D、放电时,正极质量增加二、综合题
-
8. 工业上用苯和1,2—二氯乙烷制联苄的反应原理如下

实验室制取联苄的装置如图所示(加热和夹持仪器略去)
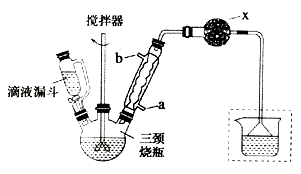
实验步骤:
①在三颈烧瓶中加入120.0mL苯和适量无水AlCl3 , 由滴液漏斗滴加10.0mL 1,2-二氯乙烷,控制反应温度在60~65℃,反应约60min。
②将反应后的混合物依次用2%Na2CO3溶液和水洗涤,在所得产物中加入少量无水MgSO4固体,静置、过滤,蒸馏收集一定温度下的馏分,得联苄18.2g。
相关物理常数和物理性质如下表:
名称
相对分子质量
密度/g·cm-3
熔点/℃
沸点/℃
溶解性
苯
78
0.88
5.5
80.1
难溶于水,易溶于乙醇
1,2-二氯乙烷
99
1.27
-35.3
83.5
难溶于水,可溶于苯
联苄
182
0.98
52
284
难溶于水,易溶于苯
(1)、和普通分液漏斗相比,使用滴液漏斗的优点是;球形冷凝管进水口是(选填“a”或“b”)(2)、仪器X的名称是;装置中虚线部分的作用是。(3)、洗涤操作中,用2%Na2CO3溶液洗涤的目的是;水洗的目的是。(4)、在进行蒸馏操作时,应收集℃的馏分。(5)、该实验中,联苄的产率约为%(小数点后保留两位)。9. 目前,我国是最大的钢铁生产国,钢铁是国民经济的基础产业,铁及其化合物的应用也越来越广泛。回答下列问题:(1)、画出铁的原子结构示意图:。(2)、工业炼铁时常用CO还原铁矿粉,已知:① Fe2O3(s) + 3CO(g)=2Fe(s)+ 3CO2(g) △H=-24.8 kJ/mol
② Fe3O4(S)+CO(g)=-3FeO(g)+CO2(g) △H= +19.4 kJ/mol
③ FeO(s)+CO(g)=Fe(s)+CO2(g) △H= -11.0 kJ/mol
则反应3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)的△H= 。
(3)、Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) 反应温度与K的关系如下表:反应温度/℃
1000
1150
1300
平衡常数K
64
50.7
42.9
恒温1000℃在体积为10L的恒容密闭容器中加入0.1molFe2O3和0.1molCO,气体混合物中CO2的体积分数φ(CO2)随时间t的变化关系如图所示。
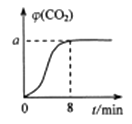
①前 8minCO 的反应速率为;平衡时a=。
②若再向平衡混合物中加入0.01molCO 和0.02molCO2 , 平衡移动;若要使平衡混合气中CO2的体积分数增大,下列措施可行的是(填标号)。
A.增大Fe2O3用量
B.增大压强
C.降低温度
D.向容器中再充入少量CO
(4)、纳米级的Fe3O4在催化剂、造影成像、药物载体、靶向给药等领域都有很好的应用前景,工业生产中常用“共沉淀法”来制备。将FeCl2和FeCl3按一定比例配成混合溶液,用NaOH溶液作为沉淀剂,在特定条件下即可制得纳米级的Fe3O4 , 反应的离子方程式是 , 在实际生产中Fe2+和Fe3+反应用量比常是2:3,甚至1:1,为什么?。(5)、纳米铁粉可用于除去废水中的NO3- , 反应的离子方程式为:4Fe+ NO3-+ 10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是;若加入少量Cu2+ , 废水中NO3-的去除速率大大加快,可能的原因是。10. 硫酸镍晶体(NiSO4•7H2O)可用于电镀工业,可用含镍废催化剂为原料来制备。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al、Fe的单质及其他不溶杂质(不溶于酸碱)。某小组通过查阅资料,设计了如下图所示的制备流程: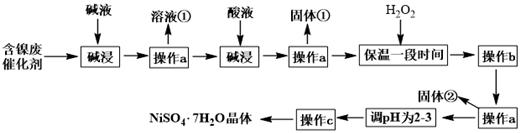
已知:Ksp[Fe(OH)3]=4.0×10-38 ,Ksp[Ni(OH)2]=1.2×10-15
(1)、“碱浸”过程中发生反应的离子方程式是。(2)、操作a所用到的玻璃仪器有烧杯、、;操作c的名称为、、过滤、洗涤。(3)、固体①是;加H2O2的目的是(用离子方程式表示)。(4)、调pH为2-3时所加的酸是。(5)、操作b为调节溶液的pH,若经过操作b后溶液中c(Ni2+)=2mol·L-1 , 当铁离子恰好完全沉淀溶液中c(Fe3+)=1.0×10-5mol·L-1时,溶液中是否有Ni(OH)2沉淀生成?(填“是”或“否”)。(6)、NiSO4•7H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在放电过程中总反应的化学方程式是NiOOH+MH=Ni(OH)2+M,则NiMH电池充电过程中,阳极的电极反应式为。11. 氮及其化合物与人类生产、生活息息相关。其中尿素(H2NCONH2) 是人类最早合成的有机物,工业上生产尿素的反应为: N2+3H2 2NH3 , 2NH3+CO2 H2NCONH2+H2O。回答下列问题:(1)、纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为 , Zn位于元素周期表的区。(2)、C、N、O三种元素第一电离能从大到小的顺序是。(3)、上述化学方程式中的无机化合物,沸点由高到低的顺序是 , 原因: 。(4)、尿素分子中,原子杂化轨道类型有 , σ键与π键数目之比为。(5)、氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1) 和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。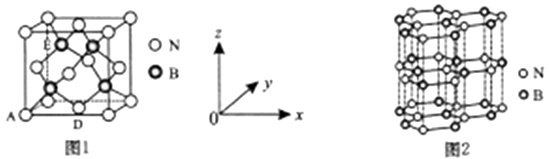
①晶胞中的原子坐标参数可表亓晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为( ),则E原子的坐标参数为。X-射线衍射实验测得立方氮化硼晶胞参数为361.5pm,则立方氮化硼晶体N 与B的原子半径之和为pm。( )
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3 , 则层与层之间距离的计算表达式为pm。
12. 以有机物A合成聚酯类高分子化合物F的路线如下图所示: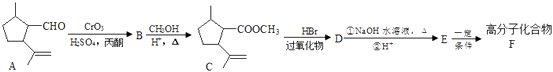
已知:①RCH =CH2
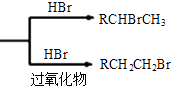 ②丙酮能被KMnO4(H+)氧化,使之褪色(1)、A 生成B的反应类型为 , C中含氧官能团的名称为。(2)、G是与CH3OH相对分子质量相差56的同系物,且不能使KMnO4(H+)褪色,G的名称为(3)、检验A分子碳碳双键的方法。(4)、D 与NaOH 水溶液反应的化学方程式为。(5)、E在一定条件下还可以合成含有六元环结构的H,则H的结构简式为。(6)、若F的平均相对分子质量为25200,则其平均聚合度为(7)、满足下列条件的C的同分异构体有种(不考虑立体异构)。
②丙酮能被KMnO4(H+)氧化,使之褪色(1)、A 生成B的反应类型为 , C中含氧官能团的名称为。(2)、G是与CH3OH相对分子质量相差56的同系物,且不能使KMnO4(H+)褪色,G的名称为(3)、检验A分子碳碳双键的方法。(4)、D 与NaOH 水溶液反应的化学方程式为。(5)、E在一定条件下还可以合成含有六元环结构的H,则H的结构简式为。(6)、若F的平均相对分子质量为25200,则其平均聚合度为(7)、满足下列条件的C的同分异构体有种(不考虑立体异构)。①含有1个六元碳环,且环上相邻4 个碳原子上各连有一个取代基
②1mol该物质与新制氢氧化铜悬浊液反应产生2mol砖红色沉淀
(8)、写出以 为原料(其他试剂任选) 制备化合物
为原料(其他试剂任选) 制备化合物 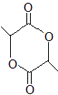 的合成路线,请用以下方式表示:A B 目标产物。
的合成路线,请用以下方式表示:A B 目标产物。