2018年全国版中考化学冲刺卷(二)
试卷更新日期:2018-05-30 类型:中考模拟
一、单选题
-
1. 下列变化说法正确的是( )A、蜡烛受热熔化和蜡烛燃烧都是物理变化 B、海水“晒盐”和海水“制碱”都是物理变化 C、葡萄光合作用和葡萄酿酒都是化学变化 D、工业上制取氧气和实验室制取氧气都是化学变化2. 下列物质中属于纯净物的是( )A、矿泉水 B、蒸馏水 C、自来水 D、海水3. 绿色化学的核心是要利用化学原理从源头上减少和消除工业生产对环境的污染,下列措施属于“绿色化学”范畴的是( )A、杜绝污染源 B、治理污染点 C、深埋有毒物 D、处理废弃物4. 下列实验操作错误的是( )A、
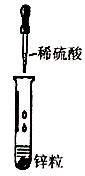 滴管的使用
B、
滴管的使用
B、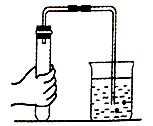 检查装置的气密性
C、
检查装置的气密性
C、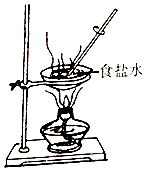 蒸发食盐水
D、
蒸发食盐水
D、 称量固体食盐
5. 下列做法正确的是( )A、用霉变的花生做食品 B、用甲醛溶液浸泡鱼虾防腐 C、食用加碘盐可补充人体缺乏的碘元素 D、食品中加入过量的亚硝酸钠6. 下列物质在水中,能形成溶液的是( )A、牛奶 B、汽油 C、泥土 D、味精7. 镓元素的单质是半导体材料。下列有关说法错误的是( )
称量固体食盐
5. 下列做法正确的是( )A、用霉变的花生做食品 B、用甲醛溶液浸泡鱼虾防腐 C、食用加碘盐可补充人体缺乏的碘元素 D、食品中加入过量的亚硝酸钠6. 下列物质在水中,能形成溶液的是( )A、牛奶 B、汽油 C、泥土 D、味精7. 镓元素的单质是半导体材料。下列有关说法错误的是( ) A、镓的核电荷数是31 B、镓原子核外电子数是31 C、镓属于非金属元素 D、镓的相对原子质量是69.728. NaClO2广泛用于造纸工业,NaClO2中氯元素的化合价为( )A、﹣1 B、0 C、+3 D、+59. 氧气能被压缩在钢瓶中贮存,说明( )A、氧分子的大小发生改变 B、氧分子可以再分 C、氧分子总是在不断运动 D、氧分子之间有间隔10. 在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,反应前后测得有关数据如下表:
A、镓的核电荷数是31 B、镓原子核外电子数是31 C、镓属于非金属元素 D、镓的相对原子质量是69.728. NaClO2广泛用于造纸工业,NaClO2中氯元素的化合价为( )A、﹣1 B、0 C、+3 D、+59. 氧气能被压缩在钢瓶中贮存,说明( )A、氧分子的大小发生改变 B、氧分子可以再分 C、氧分子总是在不断运动 D、氧分子之间有间隔10. 在密闭容器中加入甲、乙、丙、丁四种物质,使之充分反应,反应前后测得有关数据如下表:物质
甲
乙
丙
丁
反应前质量/9
18
1
2
32
反应后质量/9
X
26
2
12
下列说法不正确的是( )
A、反应后物质甲的质量为13g B、乙是反应物 C、反应中乙、丁的质量比为5:4 D、物质丙可能是该反应的催化剂11. 如图是KNO3和NaCl在水中的溶解度曲线,下列说法正确的是( ) A、20℃时,KNO3的溶解度是30 B、KNO3的溶解度大于NaCl的溶解度 C、当KNO3中含有少量NaCl时,可以通过冷却热饱和溶液的方法提纯KNO3 D、将30℃时KNO3的饱和溶液和NaCl的饱和溶液同时降温至24℃,此时所得溶液中NaCl的质量分数大于KNO3的质量分数12. 分析推理是化学学习中常用的思维方法,下列说法正确的是( )A、活泼金属能与稀硫酸反应放出气体,能与稀硫酸反应放出气体的物质一定是活泼金属 B、碱能跟酸反应生成盐和水,能跟酸反应生成盐和水的物质一定是碱 C、化合物是由不同种元素组成的纯净物,由不同种元素组成的纯净物一定是化合物 D、有机物是含有碳元素的化合物,含有碳元素的化合物一定是有机物13. 下列各组物质除杂方法正确的是( )
A、20℃时,KNO3的溶解度是30 B、KNO3的溶解度大于NaCl的溶解度 C、当KNO3中含有少量NaCl时,可以通过冷却热饱和溶液的方法提纯KNO3 D、将30℃时KNO3的饱和溶液和NaCl的饱和溶液同时降温至24℃,此时所得溶液中NaCl的质量分数大于KNO3的质量分数12. 分析推理是化学学习中常用的思维方法,下列说法正确的是( )A、活泼金属能与稀硫酸反应放出气体,能与稀硫酸反应放出气体的物质一定是活泼金属 B、碱能跟酸反应生成盐和水,能跟酸反应生成盐和水的物质一定是碱 C、化合物是由不同种元素组成的纯净物,由不同种元素组成的纯净物一定是化合物 D、有机物是含有碳元素的化合物,含有碳元素的化合物一定是有机物13. 下列各组物质除杂方法正确的是( )选项
物质(括号内为杂质)
操作方法
A
NaCl 溶液(Na2SO4)
加入适量的BaCl2溶液,过滤
B
CaO 固体(CaCO3)
加入过量的水,过滤
C
O2 (H2)
把气体通过灼热的铜网
D
CaCl2溶液(稀HCl)
加入适量的Na2CO3溶液
A、A B、B C、C D、D14. 下列四个实验方案设计不合理的是( )选项
实验目的
实验方案
A
鉴别氯化铵和尿素
分别加热熟石灰粉末研磨,闻气味
B
鉴别硝酸铵和氯化钠
分别加适量水,用手触摸容器壁
C
鉴别硫酸铜溶液和稀盐酸
分别观察溶液颜色
D
鉴别烧碱溶液和石灰水
分别滴加酚酞试液,观察颜色变化
A、A B、B C、C D、D15.从海水中制备纯碱和金属镁的流程如图所示:

下列说法不正确的是( )
A、步骤Ⅱ中吸氨的作用是使溶液呈碱性,促进二氧化碳吸收 B、第Ⅲ步反应的化学方程式是2NaHCO3Na2CO3+CO2↑+H2O C、步骤Ⅳ发生的是置换反应 D、步骤Ⅴ中所加试剂是盐酸16. 在FeCl2和CuCl2的混合溶液中加入Zn粉,下列说法错误的是( )A、若反应完成后Zn无剩余,溶液中若有CuCl2 , 则一定有FeCl2 B、若反应完成后Zn无剩余,溶液中若无CuCl2 , 则可能有FeCl2 C、若反应完成后Zn有剩余,则溶液中有ZnCl2 , 无CuCl2和FeCl2 D、若反应完成后Zn有剩余,则溶液中有ZnCl2 , 无CuCl2 , 可能有FeCl217. 图像中的化学。下列图象能正确反映对应变化关系的是 A、图像①表示足量碳在密闭容器中燃烧 B、图像②表示将铜片加入一定量的硝酸银溶液中 C、图像③表示向两份完全相同的稀盐酸中分别加入过量的锌粉和镁粉 D、图像④表示向盛有一定量MnO2的烧杯中加入H2O2溶液18. 下列图像不能正确反映对应变化关系的是( )
A、图像①表示足量碳在密闭容器中燃烧 B、图像②表示将铜片加入一定量的硝酸银溶液中 C、图像③表示向两份完全相同的稀盐酸中分别加入过量的锌粉和镁粉 D、图像④表示向盛有一定量MnO2的烧杯中加入H2O2溶液18. 下列图像不能正确反映对应变化关系的是( ) A、A B、B C、C D、D
A、A B、B C、C D、D二、填空题
-
19. 金属材料与人类的生产和生活密切相关.请回答:
a.下列用品中,主要利用金属导电性的是(填字母)
A.铂金饰品 B.铁锅 C.铝导线
b.为了验证铝、铜、银三种金属的活动性顺序,设计了下列四种方案,其中可行的是(填序号)
①将铝、银分别浸入到硫酸铜溶液中
②将银分别浸入到硫酸铝、硫酸铜溶液中
③将铜、银分别浸入到硫酸铝溶液中
④将铜分别浸入到硫酸铝、硝酸银溶液中
c.在氯化铜和氯化亚铁的混合溶液中加入一定质量的镁粉,充分反应后过滤,得到滤渣和滤液.①滤液中一定含有的溶质是(填化学式);②向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是(填化学式).
20. 金属钨(W)可做灯泡的灯丝,钨合金材料非常坚硬和耐磨、耐热.用黑钨矿(含有FeWO4)与Na2CO3混合在空气中焙烧可以得到Na2WO4 , Na2WO4与热的浓盐酸反应生成H2WO4 , H2WO4受热分解生成H2O和WO3 .(1)、钨合金材料属于 . (填选项)A、单质 B、化合物 C、纯净物 D、混合物(2)、4FeWO4+4Na2CO3+O2 4Na2WO4+2Fe2O3+4(3)、H2WO4读作 . H2WO4中钨元素的化合价为 .(4)、H2WO4受热分解的化学方程式为 .(5)、H2与WO3在1000℃条件下反应可得到金属W和水,其反应类型为 .21.水是重要的资源,我们应了解水的有关知识。

(1)A中水发生了 (填“物理”或“化学”)变化。
(2)B是电解水的实验装置,写出该反应的文字表达式是 ;用 检验b试管中产生的气体。
(3) 有同学利用所学的知识将浑浊的坑水用C图所示的简易净水器进行净化,其中小卵石、石英沙的作用是 。
(4)硬水给生活和生产带来很多麻烦,生活中可用 来区分硬水和软水,常用 的方法来降低水的硬度。
(5)地球上的总储水量虽然很大,但淡水很少,爱护水资源是每个公民的责任和义务。下列行为属于节约用水的是 (填序号)。
A.公共场所不用随手关水龙头 B.洗完菜的水用来浇花 C.不间断放水刷牙22. 实验室需要配制50g溶质质量分数为4%的氢氧化钠溶液,所需固体氢氧化钠的质量为g,主要操作步骤是:计算、、溶解.在溶解过程中用玻璃棒搅拌,其作用是 . 在量取水的过程中,某同学俯视读数,会使所配置的溶液中溶质质量分数(填“偏大”“偏小”或“不变”).
23.现有下图所示实验装置,请回答下列问题

(1)图中e、f仪器的名称:e ,f 。
(2)用氯酸钾和二氧化锰固体制氧气,选用的发生装置是A(填字母A、B、C、D),反应的化学方程式是。反应前后,二氧化锰的质量(“不变”或“变大”或“变小”)。
(3) 用块状固体和液体常温下制取气体时,用C装置(多孔隔板用来放块状固体)代替B装置的优点是。观察图C装置,气体制取处于(填“进行”或“停止”)中。
(4)实验室里用双氧水和二氧化锰反应制氧气的化学反应方程式为 , 该实验(填“能”或“不能”)选用C装置来控制反应发生或停止。若用D装置来收集生成的氧气,气体应从(填g或h)通入。24. 某小组同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行探究。【提出问题】①三种溶液的酸碱性?
②它们与酸反应时溶液的pH如何变化?
【查阅资料】
pH
2~3
4~6
7
8~9
10~11
12~14
紫甘蓝汁液显示的颜色
紫红
浅紫
紫色
蓝色
绿色
黄色
【实验1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称
蒸馏水
碳酸氢钠溶液
碳酸钠溶液
氢氧化钠溶液
紫甘蓝汁液显示的颜色
紫色
蓝色
绿色
黄色
【实验2】向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图1所示。

【实验3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图2、图3所示。将图2与图3的阴影部分进行叠加,发现两者基本重合。

【解释与结论】
(1)、实验1得出三种溶液的碱性由强到弱的顺序为。(2)、实验2证明了氢氧化钠能与盐酸发生反应,其理由是 , 实验结束,向反应后的溶液中滴加紫甘蓝汁液,观察到的现象是。(3)、实验3中,b点的溶质为 , c点后发生反应的化学方程式为。(4)、依据实验3获取的信息,鉴别Na2CO3和NaHCO3固体的实验方案为。三、计算题
-
25.
某化工厂排放的废水中含有碳酸钾和氢氧化钾,化学兴趣小组为探究废水中碳酸钾的含量,提取50g废水样品于集气瓶中,逐滴加入9.8%的稀硫酸,反应过程中产生二氧化碳的质量与加入稀硫酸的质量如图,请计算.
(1)生成二氧化碳的质量为 g;
(2)该废水中碳酸钾的质量分数(写出计算过程) ;
(3)反应后生成硫酸钾的质量为 g.
