2016-2017学年江苏省无锡市锡山区九年级上学期期中化学试卷
试卷更新日期:2016-12-29 类型:期中考试
一、选择题
-
1. 下列食品、调味品的制作过程中,没有发生化学变化的是( )A、
 鲜奶制酸奶
B、
鲜奶制酸奶
B、 黄豆酿酱油
C、
黄豆酿酱油
C、 糯米酿甜酒
D、
糯米酿甜酒
D、 水果榨果汁
水果榨果汁
-
2. 下列物质属于纯净物的是( )A、铁合金 B、洁净的空气 C、矿泉水 D、纯净的氧气
-
3. 下列实验基本操作正确的是( )A、
 加热液体
B、
加热液体
B、 向试管中加固体
C、
向试管中加固体
C、 检查装置气密性
D、
检查装置气密性
D、 闻药品的气味
闻药品的气味
-
4. 下列关于燃烧现象的描述中,正确的是( )A、铁丝在空气中剧烈燃烧,火星四射 B、硫在空气中燃烧发出淡蓝色火焰 C、红磷在空气中燃烧产生大量白色烟雾 D、碳在氧气中燃烧生成二氧化碳
-
5. 下列关于氧气的说法正确的是( )A、液态氧可用作火箭的助燃剂 B、氧气在空气中的体积分数为78% C、硫在氧气中燃烧发出黄色火焰 D、鱼类能在水中生存,证明氧气易溶于水
-
6. 如图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,其中不同的圆球代表不同原子.下列说法错误的是( )
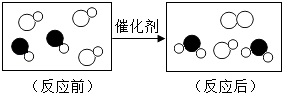 A、此反应有单质生成 B、原子在化学变化中是不可分的 C、图中生成物全部是化合物 D、参加反应的两种分子的个数比为1:1
A、此反应有单质生成 B、原子在化学变化中是不可分的 C、图中生成物全部是化合物 D、参加反应的两种分子的个数比为1:1 -
7. 水是生命之源.下列关于水的说法不正确的是( )A、水由液态变成气态时,分子间空隙变大 B、电解水生成氢气和氧气,说明水是由氢气和氧气组成 C、活性炭具有吸附性,可用于除去水中的异味 D、如果将水样蒸干后有固体析出,这种水样中一定含有杂质
-
8. 只用下列鉴别方法不能把待鉴别的物质区分开的是( )
待鉴别的物质
鉴别方法
A
二氧化碳和氮气
分别向其中伸入燃着的木条,观察燃烧情况
B
硬水和软水
加肥皂水,振荡,观察产生泡沫情况
C
过氧化氢溶液和水
加二氧化锰,观察有无气泡产生
D
氧气和空气
分别向其中伸入燃着的木条,观察燃烧情况
A、A B、B C、C D、D -
9. 锇是密度最大的金属.如图是元素周期表中锇元素的相关信息,有关说法不正确的是( )
 A、锇的原子序数是76 B、锇属于非金属元素 C、锇的元素符号是Os D、锇元素的相对原子质量是190.2
A、锇的原子序数是76 B、锇属于非金属元素 C、锇的元素符号是Os D、锇元素的相对原子质量是190.2 -
10. 在地震后的救援行动中,为了搜索埋在废墟中的幸存者,人们用了搜救犬,搜救犬能根据人体发出的气味发现幸存者.试用化学观点从微粒的角度分析能发现幸存者的原因是( )A、分子很小 B、分子在不停地运动 C、分子间有间隙 D、分子是由原子构成
-
11. 下列关于四种粒子的结构示意图的说法正确的是( )
 A、②表示的微粒在化学变化中易失去两个电子形成阳离子 B、①和③属于不同种元素 C、②和③对应的元素组成的化合物化学式为MgO2 D、④对应的元素属于金属元素
A、②表示的微粒在化学变化中易失去两个电子形成阳离子 B、①和③属于不同种元素 C、②和③对应的元素组成的化合物化学式为MgO2 D、④对应的元素属于金属元素 -
12. 苹果中富含苹果酸,苹果酸的化学式为C4H4O4 . 下列说法正确的是( )A、苹果酸中含有12个原子 B、苹果酸的相对分子质量为112 C、苹果酸中碳元素的质量分数约为41.4% D、苹果酸中C、H、O三元素的质量比为4:4:4
-
13. 推理是一种重要的化学思维方法,以下推理合理的是( )A、因为MnO2能加快H2O2的分解速率,所以MnO2也能加快H2O的分解 B、因为单质是由同种元素组成,所以只含一种元素的物质一定是单质 C、因为蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有碳元素和氢元素 D、因为H2O和H2O2的组成元素相同,所以它们的化学性质相同
-
14. 小华在实验室用氯酸钾和二氧化锰制氧气,加热一段时间后停止实验(氯酸钾未完全分解),他测得剩余物质中两种金属元素的质量分数分别为:锰元素质量分数11.0%,钾元素的质量分数39.0%,请问剩余物质中氧元素的质量分数为( )A、6.4% B、14.5% C、25.5% D、50%
二、填空题
-
15. 请用正确的化学用语填空:
①2个氮原子;
②4个亚铁离子;
③氯化钙中钙元素显+2价;
④4个铵根离子: .
⑤地壳中含量最多的金属元素和非金属元素与硫元素组成的化合物的化学式为 .
-
16. 写出下列反应的符号表达式,并注明反应基本类型:(1)、铁在纯氧中燃烧(基本反应类型:).(2)、和电解水一样,在水中加入足量食盐(氯化钠)后通电也会发生化学变化,生成氢氧化钠(NaOH),和最轻的气体及黄绿色气体氯气(Cl2),请写出对应的符号表达式 .
-
17. 建立宏观、微观和符号之间的相互联系是化学学科的特点.
 (1)、图1表示水、二氧化碳和氧气的循环图.
(1)、图1表示水、二氧化碳和氧气的循环图.①从宏观角度看,图1中三种物质的组成中都含有 , 从微观角度看,图1中三种物质都是由构成的.
②试写出图1中实现b转化的符号表达式
(2)、图2表示某反应的微观示意图,试写出相应的符号表达式(3)、图3表示氯和溴元素(Br)的原子结构示意图,由图可知,氯和溴具有相似化学性质的原因是 .
三、综合题
-
18. 小金为了探究温度对H2O2分解反应速率的影响,借助如图所示实验装置(夹持装置略去),进行了两次实验,两次实验的部分设计如表所示:

实验1
实验2
MnO2的质量/克
0.5
0.5
5%的H2O2的体积/毫升
40
待填
水浴温度/℃
20
80
(1)、实验2中应加入5%H2O2毫升;(2)、在两次实验中,可通过观察来比较H2O2分解反应速率的大小;(3)、实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因除锥形瓶内气体受热膨胀外,还有;(4)、实验结束后若要将MnO2从混合物中分离出来,可采取的实验操作方法是1、2洗涤、3干燥. -
19. 根据下列装置,结合所学化学知识回答下列问题
 (1)、写出仪器a的名称 .(2)、实验室用高锰酸钾制取氧气时,选择的发生装置是(填字母序号),若制取较干燥的氧气则收集装置是(填字母序号),发生反应的符号表达式为实验装置B通入时会产生白色浑浊,常用来检验该气体.(3)、实验室还可以用过氧化氢溶液(俗名双氧水)制取氧气,该反应的符号表达式为某实验小组同学对双氧水制氧气的若干问题进行探究.
(1)、写出仪器a的名称 .(2)、实验室用高锰酸钾制取氧气时,选择的发生装置是(填字母序号),若制取较干燥的氧气则收集装置是(填字母序号),发生反应的符号表达式为实验装置B通入时会产生白色浑浊,常用来检验该气体.(3)、实验室还可以用过氧化氢溶液(俗名双氧水)制取氧气,该反应的符号表达式为某实验小组同学对双氧水制氧气的若干问题进行探究.①利用图甲中A、B仪器可以组装一套测量氧气体积的装置,该装置导管的连接顺序是接C(填接口编号)

②A瓶中原有的空气对氧气体积测定(填“有”或“没有”)影响?
③图乙装置也可以用来测量反应中生成的氧气体 积.为了较准确的测量氧气体积,在读取量气管中液面读数时,应注意哪些问题? . 如管中出现左低右高,应将水准管(填“上移”,“下移”“不动”)
-
20. 空气中氧气含量测定的再认识.(1)、【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1).该实验中选择使用汞的优点有 .A、实验过程中没有污染 B、在汞槽中起到液封作用 C、生成的化合物加热分解又能得到汞和氧气 D、能将密闭装置内空气中的氧气几乎耗尽(2)、【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的符号表达式 . 兴趣小组用该方法测出的氧气含量常常远低于21%.
 (3)、【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量?
(3)、【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量?【进行猜想】①装置漏气;
② , 装置内氧气有剩余;
③…
(4)、【实验与交流】在老师的指导下,小明分别用过量的红磷和白磷进行该实验,用测氧气浓度的传感器测得反应后装置内氧气浓度分别为8.85%和3.21%,【实验探究1】小明根据铁生锈的原理(铁能与空气中的氧气反应),探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3)
通过7天测得的数据计算空气中氧气的含量为19.13%.
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法测定的主要优点及原因:装置内残留的氧气更少,实验结果更准确;但是反应所需时间太长.
【实验探究2】为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠(NaCl)等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
实验前的体积
实验后的体积
集气瓶内空气
烧杯内蒸馏水
烧杯内剩余蒸馏水
131mL
90.0mL
63.6mL
请计算出空气中氧气含量(计算结果保留一位小数)
(5)、【结论与反思】通过上述实验探究,选择铁粉、炭粉、氯化钠(NaCl)进行实验,可较为快速地完成实验并减小实验误差.【拓展延伸】铜也能与空气中氧气、水、二 氧化碳反应而锈蚀,生成铜绿[铜绿的主要成分为Cu2(OH)2CO3],其相对分子质量为
若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断(填“能”还是“不能”)比较准确地测定空气中氧气的含量,并说明理由 .
