江苏省苏州市太仓市2017-2018学年中考化学模拟考试试卷
试卷更新日期:2018-05-24 类型:中考模拟
一、单选题
-
1. 下列做法不符合“节能减排”的是( )
A、加大对核能的利用 B、在田野里焚烧秸秆 C、用煤炼焦、生产煤气进行综合利用 D、推广使用以电池提供动力的客车2. 下列变化属于化学变化的是( )A、食物腐烂 B、酒精挥发 C、石蜡熔化 D、矿石粉碎3. 下列物质属于纯净物的是( )A、空气 B、生铁 C、金刚石 D、碘酒4. 下列化学用语书写正确的是( )A、氧化铝:Al2O3 B、硅元素:SI C、碳酸根离子:CO3 D、三个氧原子: O35. 在进行过滤操作时,下列仪器不会使用到的是( )A、 酒精灯
B、
酒精灯
B、 烧杯
C、
烧杯
C、 漏斗
D、
漏斗
D、 玻璃棒
6. 构成二氧化碳的基本微粒是( )A、原子 B、离子 C、分子 D、电子7. 下列反应属于复分解反应的是( )A、CaO+2H2O=Ca(OH)2 B、CuSO4+2NaOH=Na2SO4+Cu(OH)2↓ C、2H2O 2H2O+O2↑ D、Zn+H2SO4=ZnSO4+H2↑8. 以下是某些同学在“测定土壤酸碱性”实验中的操作,其中错误的是( )A、
玻璃棒
6. 构成二氧化碳的基本微粒是( )A、原子 B、离子 C、分子 D、电子7. 下列反应属于复分解反应的是( )A、CaO+2H2O=Ca(OH)2 B、CuSO4+2NaOH=Na2SO4+Cu(OH)2↓ C、2H2O 2H2O+O2↑ D、Zn+H2SO4=ZnSO4+H2↑8. 以下是某些同学在“测定土壤酸碱性”实验中的操作,其中错误的是( )A、 加土壤颗粒
B、
加土壤颗粒
B、 加水溶解
C、
加水溶解
C、 振荡试管
D、
振荡试管
D、 用玻璃棒蘸取清液
9. 下列对实验现象的描述中,正确的是( )A、把铜丝放入硫酸铝溶液中,紫红色固体表面产生银白色固体,溶液变成蓝色 B、向氯化铁溶液中滴加氢氧化钠溶液,生成蓝色沉淀 C、将一氧化碳通入灼热的氧化铁,红棕色粉末逐渐变为银白色粉末 D、将羊毛线放在酒精灯火焰上灼烧,闻到烧焦羽毛的特殊气味10. 下列说法错误的是( )A、空气中N2的体积分数约为78% B、O2的化学性质比较活泼,具有可燃性 C、CO2是绿色植物光合作用的原料之一 D、稀有气体化学性质稳定,可用作保护气11. 制作下列物品所用的主要材料中,属于有机合成材料的是( )A、纯羊毛衫 B、木制桌椅 C、纯棉毛巾 D、尼龙绳12. 下列说法正确的是( )A、钙是人体中的微量元素 B、油脂是重要的营养物质,可大量摄入 C、鸡蛋含有丰富的蛋白质 D、酶都属于糖类,可为人体提供能量13. 下列事实的微观解释错误的是( )A、干冰升华——分子空隙变大 B、水烧开后把壶盖顶开——分子数目变多 C、通过气味辨别酒精和水——分子不断运动,不同分子的性质不同 D、湿衣服晾在太阳底下干得快—分子运动速率变快14. 有关下列物质的用途描述正确的是( )A、稀盐酸用于铁制品表面除锈 B、液氧作火箭发射的燃料 C、氢氧化钠用于治疗胃酸过多 D、尿素[CO(NH2)2]作优质复合肥15. 某汽水中含有的柠檬酸的化学式为C6H8O7 , 下列说法正确的是( )A、柠檬酸是氧化物 B、柠檬酸由碳、氢、氧三种原子构成 C、柠檬酸中碳、氢、氧三种元素的质量比为6:8:7 D、8g柠檬酸中含有3g碳元素16. 下列关于金属材料的说法错误的是( )A、硬铝(铝合金)的硬度大于纯铝 B、铁在干燥的空气中容易生锈 C、常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜 D、金属资源的回收利用既保护了环境,又节约了矿石资源17. 下列关于溶液说法正确的是( )A、将氯化钠和植物油放入水中,充分搅拌后都能形成溶液 B、把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10% C、向20 ℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解 D、配制50 g 16%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤18. 下列各组离子在水溶液中能大量共存的一组是( )A、H+、Na+、OH-、SO42- B、Ca2+、Na+、Cl-、CO32- C、K+、Na+、Cl-、CO32- D、NH4+、Na+、OH-、NO3-19. 下列鉴别物质的方法中,不能达到实验目的是( )A、用燃着的木条鉴别CO2和O2 B、用酚酞试液鉴别NaOH溶液和Na2CO3溶液 C、用加烧碱并研磨的方法鉴别NH4Cl与K2SO4两种固体 D、用水鉴别NH4NO3和NaCl两种固体20. t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。则下列说法正确的是( )
用玻璃棒蘸取清液
9. 下列对实验现象的描述中,正确的是( )A、把铜丝放入硫酸铝溶液中,紫红色固体表面产生银白色固体,溶液变成蓝色 B、向氯化铁溶液中滴加氢氧化钠溶液,生成蓝色沉淀 C、将一氧化碳通入灼热的氧化铁,红棕色粉末逐渐变为银白色粉末 D、将羊毛线放在酒精灯火焰上灼烧,闻到烧焦羽毛的特殊气味10. 下列说法错误的是( )A、空气中N2的体积分数约为78% B、O2的化学性质比较活泼,具有可燃性 C、CO2是绿色植物光合作用的原料之一 D、稀有气体化学性质稳定,可用作保护气11. 制作下列物品所用的主要材料中,属于有机合成材料的是( )A、纯羊毛衫 B、木制桌椅 C、纯棉毛巾 D、尼龙绳12. 下列说法正确的是( )A、钙是人体中的微量元素 B、油脂是重要的营养物质,可大量摄入 C、鸡蛋含有丰富的蛋白质 D、酶都属于糖类,可为人体提供能量13. 下列事实的微观解释错误的是( )A、干冰升华——分子空隙变大 B、水烧开后把壶盖顶开——分子数目变多 C、通过气味辨别酒精和水——分子不断运动,不同分子的性质不同 D、湿衣服晾在太阳底下干得快—分子运动速率变快14. 有关下列物质的用途描述正确的是( )A、稀盐酸用于铁制品表面除锈 B、液氧作火箭发射的燃料 C、氢氧化钠用于治疗胃酸过多 D、尿素[CO(NH2)2]作优质复合肥15. 某汽水中含有的柠檬酸的化学式为C6H8O7 , 下列说法正确的是( )A、柠檬酸是氧化物 B、柠檬酸由碳、氢、氧三种原子构成 C、柠檬酸中碳、氢、氧三种元素的质量比为6:8:7 D、8g柠檬酸中含有3g碳元素16. 下列关于金属材料的说法错误的是( )A、硬铝(铝合金)的硬度大于纯铝 B、铁在干燥的空气中容易生锈 C、常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜 D、金属资源的回收利用既保护了环境,又节约了矿石资源17. 下列关于溶液说法正确的是( )A、将氯化钠和植物油放入水中,充分搅拌后都能形成溶液 B、把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10% C、向20 ℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解 D、配制50 g 16%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤18. 下列各组离子在水溶液中能大量共存的一组是( )A、H+、Na+、OH-、SO42- B、Ca2+、Na+、Cl-、CO32- C、K+、Na+、Cl-、CO32- D、NH4+、Na+、OH-、NO3-19. 下列鉴别物质的方法中,不能达到实验目的是( )A、用燃着的木条鉴别CO2和O2 B、用酚酞试液鉴别NaOH溶液和Na2CO3溶液 C、用加烧碱并研磨的方法鉴别NH4Cl与K2SO4两种固体 D、用水鉴别NH4NO3和NaCl两种固体20. t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氯化钾的溶解度曲线如图2所示。则下列说法正确的是( ) A、烧杯①的溶液一定是不饱和溶液 B、烧杯①的溶液是硝酸钾溶液 C、t1℃时烧杯②的溶液的溶质质量分数为25 % D、若烧杯①和烧杯②的溶液都升温到t2℃时,两种溶液的溶质质量分数相等21. 除去下列物质中的少量杂质(括号内为杂质),所选试剂及操作都正确的是( )
A、烧杯①的溶液一定是不饱和溶液 B、烧杯①的溶液是硝酸钾溶液 C、t1℃时烧杯②的溶液的溶质质量分数为25 % D、若烧杯①和烧杯②的溶液都升温到t2℃时,两种溶液的溶质质量分数相等21. 除去下列物质中的少量杂质(括号内为杂质),所选试剂及操作都正确的是( )序号
物质
试剂及操作
A
KCl溶液(K2CO3)
加入适量的稀盐酸至无气体产生
B
Na2SO4溶液(H2SO4)
加入适量的氢氧化钡溶液、过滤
C
Fe( Cu)
过量稀硫酸、过滤
D
MnO2粉末(KCl)
加入适量的水,溶解、过滤、蒸发、结晶
A、A B、B C、C D、D22. 推理和归纳是学习化学的重要方法。下列归纳推理正确的是( )A、单质是由同种元素组成的,所以由同种元素组成的纯净物一定是单质 B、离子是带电荷的微粒,所以带电荷的微粒一定是离子 C、酸碱中和反应生成盐和水,则生成盐和水的反应都是中和反应 D、碳酸盐与盐酸反应放出气体,则与盐酸反应放出气体的物质都是碳酸盐23. 甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是( )
选项
甲
乙
丙
A
C
CO2
CO
B
H2O2
O2
H2O
C
CuO
Cu
CuSO4
D
NaOH
NaCl
NaNO3
A、A B、B C、C D、D24. 将一定质量的锌粉放入到硝酸亚铁、硝酸银和硝酸镁的混合溶液中,充分反应后过滤,得到滤渣和滤液。以下判断正确的是( )A、若向滤渣中加入盐酸,滤渣部分溶解,则原滤渣中一定含有银和锌 B、若向滤渣中加入盐酸有气体生成,则滤液中只有硝酸镁和硝酸锌 C、若向滤液中加入稀盐酸无白色沉淀生成,则滤液中可能有硝酸亚铁 D、若反应后所得滤液是无色的,则滤渣中一定有锌、铁、银25. 关于水的说法正确的是( )A、水蒸气遇冷凝结成水,说明水分子体积变小 B、生活中常用肥皂水将硬水转化成软水 C、通过电解水实验说明水是由氢氧两种元素组成的 D、天然水经过自来水厂净化后得到的是纯净物二、简答题
-
26. 左列中的每一种物质只能与右列中的一种物质发生反应,请用线段连接有相应关系的两列间的点(每个点只能连接1次)。

三、填空题
-
27. 化学与人类生活、生产息息相关。请回答下列问题:(1)、身体一旦缺铁可能患有的疾病是。(2)、用铜做导线是利用铜的延展性和性。(3)、活性炭由于具有很强的性,可以清除冰箱内的异味。(4)、工业上,煤炭燃烧前进行粉碎的目的是。(5)、用下列物质除去油污时,利用乳化作用的是(选填序号)。
①汽油 ②洗洁精
28. 写出下列反应的化学方程式。
(1)、实验室用高锰酸钾制取氧气:。(2)、铁丝在氧气中燃烧:。(3)、熟石灰中和含硫酸的废水:。(4)、碳酸氢铵受热分解:。(5)、镁在二氧化碳中燃烧生成氧化镁和碳单质:。四、综合题
-
29. 某兴趣小组进行CO2气体的制取、并验证CO2能与NaOH发生化学反应的实验。
 (1)、用上图装置制取CO2气体。
(1)、用上图装置制取CO2气体。①写出反应的化学方程式:。
②A装置用分液漏斗加液,与用长颈漏斗加液比较,其优点是。
③从B装置中取出收集满CO2气体集气瓶的操作是。
(2)、通过C装置验证CO2能与NaOH发生化学反应。推注射器活塞向充满CO2的集气瓶中注入过量溶质质量分数为20%的NaOH溶液,振荡集气瓶后打开止水夹。
①打开止水夹后观察到的现象是。
②反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有。
30. 氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。CuCl的制备流程如下: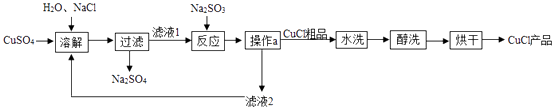 (1)、“滤液1”中除了Na+、SO42-外,还存在较多的离子是(写离子符号)。(2)、“反应”中发生的化学变化是2CuCl2+2Na2SO3=2CuCl↓+2NaCl+SO3 , 产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为。(3)、“操作a”的名称是。“醇洗”的目的是。(4)、本流程中可以循环利用的物质(水除外)是(写化学式)。(5)、320 g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是g。31. 将40 g氢氧化钠溶液逐滴加入到20 g溶质质量分数为0. 365%的稀盐酸中,边滴加边搅拌。随着氢氧化钠溶液的滴加,溶液的pH变化如左图所示,溶液的温度变化如右图所示。试回答:
(1)、“滤液1”中除了Na+、SO42-外,还存在较多的离子是(写离子符号)。(2)、“反应”中发生的化学变化是2CuCl2+2Na2SO3=2CuCl↓+2NaCl+SO3 , 产生的SO3迅速与水化合生成一种酸,该反应的化学方程式为。(3)、“操作a”的名称是。“醇洗”的目的是。(4)、本流程中可以循环利用的物质(水除外)是(写化学式)。(5)、320 g CuSO4与足量NaCl经上述制备流程,可生成的CuCl最多是g。31. 将40 g氢氧化钠溶液逐滴加入到20 g溶质质量分数为0. 365%的稀盐酸中,边滴加边搅拌。随着氢氧化钠溶液的滴加,溶液的pH变化如左图所示,溶液的温度变化如右图所示。试回答: (1)、上右图从A到B过程中,溶液的pH逐渐(填“增大”或“减小”)。(2)、上右图从B到C过程中,溶液温度降低的原因是。(3)、C点对应的溶液中含有的微粒有(用符号表示)。(4)、计算氢氧化钠溶液的溶质质量分数。(写出计算过程)
(1)、上右图从A到B过程中,溶液的pH逐渐(填“增大”或“减小”)。(2)、上右图从B到C过程中,溶液温度降低的原因是。(3)、C点对应的溶液中含有的微粒有(用符号表示)。(4)、计算氢氧化钠溶液的溶质质量分数。(写出计算过程)五、科学探究题
-
32. 碘化钾(KI)是白色固体,保存不当会被氧化为单质碘( I2)而泛黄变质。化学兴趣小组查得以下资料:
Ⅰ.对于碘化钾变质的原理,有两种不同的反应:
甲:4 KI+O2 +2CO2= 2K2CO3 +2I2 乙:4KI+ O2 +2H2O=4KOH +2I2
Ⅱ. KOH与NaOH两者的化学性质相似。为探究碘化钾变质原理的合理性,进行以下实验。
【实验过程】
[实验1]取适量碘化钾固体暴露于空气中一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
(1)、石灰水变浑浊的原因是(用化学方程式表示)。(2)、化学兴趣小组的同学认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是。(3)、[实验2]按甲图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。据此现象,可得出的结论是。
(4)、[实验3]按乙图所示装置进行实验,数日后,观察到碘化钾固体无泛黄现象。
查阅文献获知,常温下某些气体和固体反应须在潮湿环境中进行。化学兴趣小组据此改进实验,很快观察到固体泛黄的现象。
简述化学兴趣小组改进实验的具体措施:。
(5)、【实验结论】根据上述实验,化学兴趣小组得出结论:碘化钾固体泛黄变质是碘化钾与共同作用的结果。
-