广东省广州市番禺区2017-2018学年中考化学一模考试试卷
试卷更新日期:2018-05-24 类型:中考模拟
一、单选题
-
1. 下列变化中属于化学变化的是( )A、铁水铸锅 B、用汽油除去衣服上的油污 C、海水晒盐 D、粮食酿酒2. 下列物质属于纯净物的是( )A、煤 B、氢气 C、生铁 D、生理盐水3. 下列有关空气的说法中,错误的是( )A、按质量计算,空气中含有氮气约78%,氧气约21% B、空气中各种成分的含量是相对稳定的 C、空气中的氧气可以供给呼吸、支持燃烧、炼钢、化工生产等 D、PM2.5是造成空气污染的主要污染物之一4. 下列说法正确的是( )A、红磷在空气中燃烧时,产生大量的白雾 B、硝酸钾不属于复合肥 C、棉花、羊毛、蚕丝都是天然纤维 D、涤纶和乙烯都是有机合成材料5. 下列有关金属或合金的说法中,正确的是( )A、钢是一种化合物 B、生铁和钢的性能完全相同 C、在自然界中所有金属都以化合物的形式存在 D、黄铜的硬度比纯铜的硬度大6. 锂电池是新型的高能电池,质量轻、电容量大,颇受手机、电脑等用户的青睐。某种锂电池的总反应可表示为Li + MnO2 = LiMnO2。下列说法错误的是( )A、LiMnO2中锰元素的化合价为+4价 B、该反应是化合反应 C、该反应中Li的化合价发生了变化 D、MnO2属于氧化物7. 下列化学反应属于置换反应的是( )A、CH4+2O2 CO2+2H2O B、3Fe+2O2 Fe3O4 C、8Al + 3Fe3O4 4Al2O3 + 9Fe D、2H2O 2H2↑ + O2 ↑8. 下列有关水的说法中,错误的是( )A、水是一种常用的溶剂 B、电解水得到的氧气和氢气的体积比为2:1 C、常用肥皂水来鉴别硬水和软水 D、保护水资源是全人类的责任9.
下列实验设计不能达到实验目的是()
 A、A B、B C、C D、D10. 为及时发现燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH),乙硫醇也可以充分燃烧,化学方程式为:2C2H5SH+9O2 4CO2+2X+6H2O。下列关于X的说法正确的是( )
A、A B、B C、C D、D10. 为及时发现燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH),乙硫醇也可以充分燃烧,化学方程式为:2C2H5SH+9O2 4CO2+2X+6H2O。下列关于X的说法正确的是( )
A、X由碳、硫、氧二种元素组成 B、X属于有机化合物 C、X中硫、氧元素的原子个数比为1:2 D、X中氧元素的质量分数为60%11. 欲配制10.0%的NaCl溶液50g,部分操作如下图所示,正确的是( )A、 取固体
B、
取固体
B、 称固体
C、
称固体
C、 量取水
D、
量取水
D、 写标签
12. 甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是( )
写标签
12. 甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是( )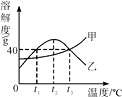 A、t1 ℃时,甲的溶解度大于乙的溶解度 B、t2 ℃时,乙的饱和溶液升温或降温均会析出晶体 C、乙溶液从t3 ℃降温到t1 ℃,乙溶液中的溶质质量分数会发生改变 D、t3 ℃时,50 g水中加入40 g的甲物质充分溶解可得到90 g甲的饱和溶液13. 下列关于溶液的说法正确的是( )
A、t1 ℃时,甲的溶解度大于乙的溶解度 B、t2 ℃时,乙的饱和溶液升温或降温均会析出晶体 C、乙溶液从t3 ℃降温到t1 ℃,乙溶液中的溶质质量分数会发生改变 D、t3 ℃时,50 g水中加入40 g的甲物质充分溶解可得到90 g甲的饱和溶液13. 下列关于溶液的说法正确的是( )
A、能溶解其他物质的物质叫做溶剂 B、凡是均一的、稳定的液体一定是溶液 C、溶液一定是无色透明的 D、饱和溶液一定是浓溶液14. 下列关于碳及碳的氧化物的说法正确的是( )A、用煤火取暖时应注意通风,防止二氧化碳中毒 B、CO2和CO在一定的条件下都能与CuO反应 C、CO2和CO都是植物进行光合作用必需的物质 D、古代用墨书写或绘制的字画长久不变色,是因为碳的化学性质不活泼15. 将稀硫酸滴加到氢氧化钠和酚酞的混合液中,同时利用仪器测得烧杯中溶液的pH的变化,如右图所示,下列说法正确的是( ) A、a点呈酸性 B、b点到c点之间发生了酸碱中和反应。 C、b点所示的溶液中,溶质只有Na2SO4。 D、由图像信息可知,由a点到b点的现象为溶液由无色变红色16. 下列实验操作、现象与结论对应关系正确的是( )
A、a点呈酸性 B、b点到c点之间发生了酸碱中和反应。 C、b点所示的溶液中,溶质只有Na2SO4。 D、由图像信息可知,由a点到b点的现象为溶液由无色变红色16. 下列实验操作、现象与结论对应关系正确的是( )选项
实验操作
现象
结论
A
向Na2CO3溶液中滴入酚酞溶液
溶液变红色
Na2CO3溶液呈碱性
B
往NaOH溶液中加入稀盐酸
没有明显现象
NaOH 和盐酸不反应
C
用燃着的木条伸进某瓶气体中
木条熄灭
该气体一定是CO2
D
把MnO2加入过氧化氢溶液中
快速产生气泡
MnO2能增加O2的产量
A、A B、B C、C D、D17. 向硫酸亚铁和硫酸铜的溶液中加入一定量的金属镁,充分反应后过滤,向滤渣中加入稀盐酸,有气泡冒出,根据上述现象,得出的结论正确的是( )A、滤渣中一定有铁 B、滤渣中只有铜 C、滤渣中一定有镁 D、滤渣中一定有铜、铁、镁18. 推理是一种主要的研究和学习方法。下列推理正确的是( )A、铁丝能在氧气中燃烧,空气中有氧气,所以铁丝能在空气中燃烧 B、将二氧化碳通入澄清石灰水中能够产生白色沉淀,因此一种无色溶液中通入二氧化碳后产生白色沉淀,则该无色溶液一定为澄清石灰水。 C、物质发生化学变化时伴随有能量变化,所以有放热、吸热现象一定是发生化学变化 D、某物质在氧气中燃烧有CO2生成,所以该物质一定含有碳元素19. 除去下列物质中混有的少甘杂质(括号内为杂质),拟定的实验方案不可行的是( )A、FeCl2溶液(CuCl2) ——加入过量的铁粉,过滤 B、KCl固体(KClO3)——加入少量的二氧化锰,并加热 C、CO气体(CO2)——通过足量的氢氧化钠溶液,并干燥 D、NaCl溶液(MgCl2) ——加入过量的氢氧化钠溶液,过滤,滤液中加稀盐酸至中性20. 甲乙丙有如图所示的转化关系(“→”表示反应一步实现,部分反应物和反应条件略去),下列各组物质按照甲乙丙的顺序不符合要求的是( ) A、C、CO2、CO B、H2O2、O2、H2O C、CuO、Cu、Cu(NO3)2 D、NaOH、NaCl、NaNO3
A、C、CO2、CO B、H2O2、O2、H2O C、CuO、Cu、Cu(NO3)2 D、NaOH、NaCl、NaNO3二、填空题
-
21. 钛(Ti)具有硬度大,密度小,熔点高,抗腐蚀性能好等优良性能,被誉为“未来金属”。现有5种含钛元素的物质:Ti、TiO2、Ti2O3、TiCl4、K2TiO3。回答下列问题:(1)、Ti2O3读作。(2)、上述5种物质中钛元素的化合价一共有种。(3)、从物质分类的角度看,K2TiO3属于_______。(填选项)A、盐 B、氧化物 C、碱(4)、已知Ti2(SO4)3溶于水溶液呈紫色。Ti2O3(紫黑色固体)在加热条件下可溶于硫酸,生成Ti2(SO4)3 。可观察的现象是。22. 下图中,①是钠元素在元素周期表中的信息,A、B、C是三种粒子的结构示意图。

试回答下列问题:
(1)、钠元素的原子序数为;(2)、A,B,C中属于同种元素的粒子是(写字母编号);(3)、A和B两种粒子的相同,所以它们有相似的化学性质;在化学反应中它们容易(填“得到”或“失去”)电子;(4)、C所表示的粒子是(填“原子”或“离子”)。23. 下图是包含物质A、B、C、D和盐酸卡片的“化学拼图”,相邻两张卡片所标的物质(或其溶液)间能发生反应。 (1)、A不可能是(填标号)。
(1)、A不可能是(填标号)。a.Mg
b.Fe
c.Ag
d.Zn
(2)、若B为铁锈的主要成分Fe2O3 , B与盐酸反应的化学方程式为。(3)、若C为碳酸钠①C与D的反应属于(填基本反应类型)。
②D与盐酸反应的化学方程式为(写一个)。
③将二氧化碳通入C溶液,可化合生成碳酸氢钠( NaHCO3),该反应的反应物有种。
三、综合题
-
24. 现实验室要把20%的硫酸配制成5%的稀硫酸,小洪同学看了室内温度计上的示数为25℃。查了书本中不同温度下各浓度的硫酸密度(g/mL),部分数据如下:
H2SO4浓度%
15℃时密度
20℃时密度
25℃时密度
30℃时密度
15
1.1045
1.1020
1.0994
1.0968
20
1.1424
1.1394
1.1365
1.1335
25
1.1816
1.1783
1.1750
1.1718
(1)、从表中数据分析,可以得出不同质量分数硫酸的密度与温度的关系为: 。(2)、25℃时要配制20g质量分数为5%的稀硫酸,需要质量分数为20%的硫酸的体积为ml(保留小数点后一位小数),需要量取水mL。(3)、将质量分数为98%的浓硫酸稀释为质量分数为20%的稀硫酸溶液时,下列操作正确的是(填序号)。①将浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里
②倾倒时,试剂瓶口要紧挨着烧杯壁
③震荡,使烧杯内的溶液混合均匀
25. 利用下列仪器进行气体的制取实验。请根据要求填空。 (1)、实验室为制取一瓶较纯净的氧气,选取了加热氯酸钾与二氧化锰的方法,应选取的装置组合是(填字母,下同),如果改用过氧化氢溶液制取氧气,制取1.6g氧气,需要5%的过氧化氢溶液的质量为:g。(2)、实验室用硫化亚铁(FeS)固体与稀硫酸混合制硫化氢气体,该反应的化学方程式是 , 选用的发生装置是;(3)、某同学用大理石与浓盐酸反应制取二氧化碳时,发现收集到的二氧化碳气体中混入大量氯化氢气体和水蒸气,于是使用了下边装置进行处理,得到纯净、干燥的二氧化碳。那么混合气体应先进入装置再进入装置。
(1)、实验室为制取一瓶较纯净的氧气,选取了加热氯酸钾与二氧化锰的方法,应选取的装置组合是(填字母,下同),如果改用过氧化氢溶液制取氧气,制取1.6g氧气,需要5%的过氧化氢溶液的质量为:g。(2)、实验室用硫化亚铁(FeS)固体与稀硫酸混合制硫化氢气体,该反应的化学方程式是 , 选用的发生装置是;(3)、某同学用大理石与浓盐酸反应制取二氧化碳时,发现收集到的二氧化碳气体中混入大量氯化氢气体和水蒸气,于是使用了下边装置进行处理,得到纯净、干燥的二氧化碳。那么混合气体应先进入装置再进入装置。
四、流程题
-
26. 生产金属镁后的废渣可以综合利用制备光卤石(MgCl2·6H2O)和金属镁,其工业流程如下图所示:

已知:①废渣的主要成分:MgCl2、KCl、MgO、BaCl2、CaCl2、粉尘等杂质。
②MgCO3微溶于水,本题中视为可溶。
回答下列问题:
(1)、将废渣粉碎的作用是。(2)、流程中往滤液I中加入Na2CO3时发生了多个化学反应,请写出其中能够产生气体的那个化学方程式。(3)、滤渣Ⅱ的主要成分和;母液的主要成分有3种,分别是MgCl2、和。(4)、操作a包含多个操作,分别为过滤,洗涤,干燥。五、简答题
-
27. NaCl在生产和生活中具有广泛的用途,是一种重要的资源。通过晾晒海水可以得到粗盐和母液(又叫苦卤)。下图为母液中最主要的四种盐(NaCl、KCl、MgCl2、MgSO4)的溶解度曲线图。回答下列问题:
 (1)、①90℃时,四种盐中MgCl2的溶解度最大,则表示 MgCl2溶解度曲线的是。(填“A”或“B”)此时饱和MgCl2溶液的质量分数为(请写出计算表达式即可)
(1)、①90℃时,四种盐中MgCl2的溶解度最大,则表示 MgCl2溶解度曲线的是。(填“A”或“B”)此时饱和MgCl2溶液的质量分数为(请写出计算表达式即可)②四种盐中溶解度受温度变化的影响最小的 是。(填化学式)
(2)、60℃时,若母液中的NaCl、KCl、MgCl2、MgSO4都已达到饱和,为了获得较纯净的MgSO4晶体,可采用的方法是。(3)、工业上常通过加入碱溶液与母液中的Mg2+反应来制取Mg(OH)2沉淀。为了探究获得较高Mg2+沉淀率的反应条件,进行下列对比实验(每组实验取250mL母液):实验序号
反应温度/℃
反应时间/min
反应pH值
Mg2+的沉淀率/%
a
40
60
10
90.1
b
40
60
12
92.7
c
40
90
12
93.6
d
50
60
12
96.4
e
50
90
12
x
①反应过程中需测定溶液的pH,则测定溶液pH的操作是:先在玻璃片上放一小片pH试纸,然后用 , 再将试纸显示的颜色与标准比色卡比较,读取溶液的pH。
②实验a和b对比,可得到的结论是。
③表格中X的数值可能为(填编号)。
A.95.8
B.92.1
C.97.2
D.93.1
六、实验题
-
28. CO2在高温下能与木炭反应生成CO。为验证该反应,某课外兴趣小组设计了一套实验装置,装置图如下:
 (1)、根据装置图,填写下表:
(1)、根据装置图,填写下表:仪器标号
仪器中所加物质
作用
A
石灰石,稀盐酸
石灰石与盐酸作用产生CO2
B
饱和碳酸氢钠溶液(与CO2不反应)
除去CO2中的HCl气体
C
D
E
(2)、D处要增加的仪器的名称是。七、科学探究题
-
29. 某草木灰(主要成分为K2CO3 , 杂质不溶于水)样品,可能还添加了K2SO4、KCl。某化学兴趣小组进行了如下实验:(1)、样品的预处理:

①操作a的名称为 , 其目的是
②溶液A中主要的阴离子,除CO32-外,可能还含有(填离子符号)
(2)、样品成分的确定:设计实验方案,完成下述表格;限选试剂:稀盐酸、稀硝酸、稀硫酸、氯化钡溶液、硝酸钡溶液、硝酸银溶液实验操作
预期现象和必要结论
步骤1:取溶液A少量于试管中,加入足量
, 充分振荡,静置,过滤。

步骤2:取少量步骤1所得的滤液于试管中,
, 说明样品中未添加KCl
步骤3:取少量步骤1所得的滤渣于试管中,
, 说明样品中添加了K2SO4
-
-
-