上海市松江区2017-2018学年高考理综-化学二模考试试卷
试卷更新日期:2018-05-24 类型:高考模拟
一、单选题
-
1. 常用于治疗胃酸过多的是( )
A、碳酸钠 B、氢氧化铝 C、氧化钙 D、硫酸钡2. 下列我国古代的技术应用中,其工作原理不涉及化学反应的是( )A、火药使用 B、粮食酿酒 C、转轮排字 D、湿法炼铜3. 漂粉精的有效成分是( )A、Ca(ClO)2 B、CaCl2 C、CaCO3 D、Ca(OH)24. 将两种互不相溶的液体分离的方法是( )A、结晶 B、分液 C、蒸馏 D、过滤5. 以下过程与化学键断裂无关的是( )
A、氯化钠熔化 B、金刚石熔化 C、金属汞汽化 D、干冰升华6. 有关35Cl和37Cl的说法正确的是( )A、核外电子数不同 B、化学性质不同 C、互为同位素 D、中子数相同7. 一定条件下,氨气与氟气发生反应:4NH3+3F2→NF3+3NH4F,其中NF3空间结构与NH3相似。下列有关说法错误的是( )A、反应物和生成物均为共价化合物 B、NF3空间结构为三角锥形 C、NF3中只含极性共价键 D、NH4F中既含有离子键又含有共价键8. 具有下列性质的物质可能属于离子晶体的是( )
A、熔点113 ℃,能溶于CS2 B、熔点44℃,液态不导电 C、熔点1124℃,易溶于水 D、熔点180 ℃,固态能导电9. 不能检验溶液中I- 的试剂是( )
A、AgNO3、稀HNO3 B、氯水、CCl4 C、氯水、淀粉 D、KBr、稀HCl10. 侯氏制碱法制造纯碱同时副产氯化铵。在母液处理上,有关说法错误的是( )
A、水浴加热,有利于NH4Cl更多地析出 B、加入食盐,增大Cl-的浓度,使NH4Cl更多地析出 C、通入氨气,增大NH4+的浓度,使NH4Cl更多地析出 D、通入氨气,使NaHCO3转化为Na2CO3 , 提高析出的NH4Cl纯度11. 工业电解饱和食盐水时,产生氢气的电极是( )A、阳极 B、阴极 C、正极 D、负极12. 可用来鉴别乙醇、乙醛的试剂是( )
A、银氨溶液 B、乙酸溶液 C、氯化铁溶液 D、氢氧化钠溶液13. 下列排列的顺序错误的是( )A、羟基氢原子的活泼性:CH3COOH>H2O>C2H5OH B、碱性:NaOH>Mg(OH)2>Al(OH)3 C、原子半径:Na>Al>O D、热稳定性:HCl>PH3>H2S14. 制备乙酸丁酯实验装置正确的是 ( )
A、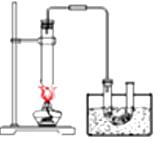 B、
B、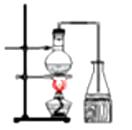 C、
C、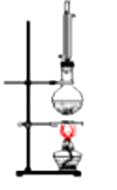 D、
D、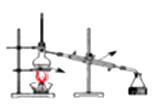 15. 配制一定物质的量浓度的NaCl溶液时,下列因素对结果没有影响的是( )A、溶解过程中有少量液体溅出 B、容量瓶使用前未干燥 C、洗涤液未全部转移到容量瓶中 D、定容时液面未到刻度线16. 研究电化学腐蚀及防护的装置如右图所示。有关说法正确的是( )
15. 配制一定物质的量浓度的NaCl溶液时,下列因素对结果没有影响的是( )A、溶解过程中有少量液体溅出 B、容量瓶使用前未干燥 C、洗涤液未全部转移到容量瓶中 D、定容时液面未到刻度线16. 研究电化学腐蚀及防护的装置如右图所示。有关说法正确的是( )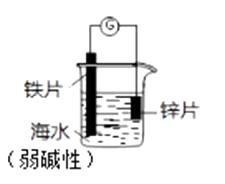 A、锌片发生氧化反应作阴极 B、电子从铁片经过导线流向锌片 C、铁片上电极反应为:2H+ + 2e→H2↑ D、该装置可用于研究牺牲阳极的阴极保护法17. 将等物质的量的Cl2和SO2通入BaCl2溶液,充分反应后滴入品红溶液,能观察到的现象是:①出现沉淀;②不出现沉淀;③品红溶液褪色;④品红溶液不褪色( )A、①④ B、①③ C、①② D、②④18. 能用离子方程式H++ OH-→ H2O 表示的反应是( )A、氨水和盐酸 B、氢氧化钠溶液和醋酸 C、硫酸和氢氧化钡溶液 D、硝酸和澄清石灰水19. 常温下pH=2的某酸HA和pH=12的NaOH溶液等体积混合,则所得溶液的pH( )A、=7 B、≥7 C、≤7 D、以上均有可能20. NA表示阿伏加德罗常数。硫与浓硝酸反应的化学方程式为:S+6HNO3(浓)→H2SO4+6NO2↑+2H2O,有关说法正确的是( )A、氧化剂与还原剂物质的量之比为1:6 B、每产生2.24升NO2转移电子0.1NA个 C、随着反应进行溶液的酸性逐渐增强 D、氧化性:HNO3(浓)>H2SO4
A、锌片发生氧化反应作阴极 B、电子从铁片经过导线流向锌片 C、铁片上电极反应为:2H+ + 2e→H2↑ D、该装置可用于研究牺牲阳极的阴极保护法17. 将等物质的量的Cl2和SO2通入BaCl2溶液,充分反应后滴入品红溶液,能观察到的现象是:①出现沉淀;②不出现沉淀;③品红溶液褪色;④品红溶液不褪色( )A、①④ B、①③ C、①② D、②④18. 能用离子方程式H++ OH-→ H2O 表示的反应是( )A、氨水和盐酸 B、氢氧化钠溶液和醋酸 C、硫酸和氢氧化钡溶液 D、硝酸和澄清石灰水19. 常温下pH=2的某酸HA和pH=12的NaOH溶液等体积混合,则所得溶液的pH( )A、=7 B、≥7 C、≤7 D、以上均有可能20. NA表示阿伏加德罗常数。硫与浓硝酸反应的化学方程式为:S+6HNO3(浓)→H2SO4+6NO2↑+2H2O,有关说法正确的是( )A、氧化剂与还原剂物质的量之比为1:6 B、每产生2.24升NO2转移电子0.1NA个 C、随着反应进行溶液的酸性逐渐增强 D、氧化性:HNO3(浓)>H2SO4二、综合题
-
21. I.2Al+Fe2O3 Al2O3+2Fe在化学反应过程中产生超高热,曾用于钢轨焊接。完成下列填空:(1)、氧元素在元素周期表中的位置为 , 其离子结构示意图为。(2)、铝盐常用作净水剂,用文字和化学用语进行解释。(3)、氧的非金属性强于氮,用元素周期律知识分析原因。(4)、Al2O3与NaOH溶液反应的离子方程式为。(5)、II.NH4Al(SO4)2·12H2O水溶液呈性(选填“酸”、“碱”或“中”),比较溶液中离子浓度大小c(NH4+)c(Al3+)(选填“>”、“<”或“=”)。22. 2SO2(g)+O2(g) 2SO3(g) +Q ,是接触法生产硫酸的主要反应之一。
完成下列填空:
(1)、生产过程中温度控制在400℃~500℃,目的是;该反应无需加压的原因是。(2)、上述反应在密闭容器中达到化学平衡状态的标志为。(3)、上述反应的平衡常数表达式为 , 随着温度升高,平衡常数(选填“增大”、“减小”或“不变”)。(4)、接触法生产硫酸尾气中含有SO2 , 可以采用氨水吸收 , 生成(NH4)2SO3与NH4HSO3的混合溶液。反应所得(NH4)2SO3又可以将NO2转化为N2和(NH4)2SO4。① 写出生成NH4HSO3的化学方程式。
② 书写NO2与(NH4)2SO3反应的化学方程式,标出该反应中电子转移的方向和数目。
三、实验题
-
23. 铁矿石主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有一种测定铁矿石中含铁量的方法如下。
已知:2Na2S2O3+I2→Na2S4O6+2NaI
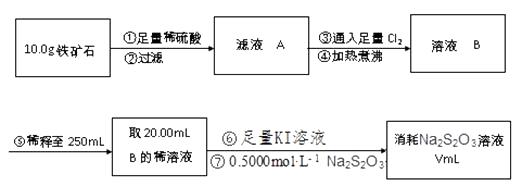
完成下列填空:
(1)、步骤②用到的玻璃仪器除烧杯外,还有、 , 步骤⑤中必须用到的定量实验仪器是。(2)、步骤③对应反应的离子方程式为。(3)、步骤④中煮沸的作用是。(4)、步骤⑦可用淀粉作为滴定终点的指示剂,达到滴定终点时的现象是。若滴定过程中有空气进入,则测定结果。(选填“偏高”、“偏低”或“无影响”)(5)、若过程⑦中消耗0.5000mol·L−1 Na2S2O3溶液20.00mL,则铁矿石中铁的百分含量为。四、推断题
-
24. 1,4-环己二醇(有机物G)是重要的医药中间体和新材料单体,可通过以下流程制备。
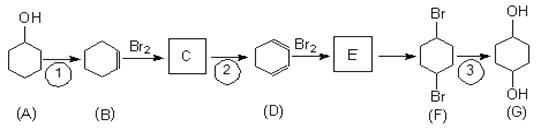
完成下列填空:
(1)、写出C的结构简式 , G中官能团名称为。(2)、写出反应①的化学方程式 。(3)、一定条件下D脱氢反应得到苯。写出苯发生硝化反应的化学方程式。(4)、检验F中存在溴元素的方法是。(5)、写出由CH2=CHCH2Br合成CH3CH2COOCH2CH2CH3的路线。(合成路线常用的表示方式为 : )
-