上海市青浦区2017-2018学年高考理综-化学二模考试试卷
试卷更新日期:2018-05-24 类型:高考模拟
一、单选题
-
1. 下列物质属于混合物的是( )
A、冰醋酸 B、石油裂解气 C、硫磺 D、酒精2. 干冰气化时,发生变化的是( )A、分子间作用力 B、分子内共价键 C、分子的大小 D、分子的化学性质3. 为了防止贮存液氯的钢筒被腐蚀,钢筒在装氯之前必须( )A、除去铁锈 B、用盐酸清洗 C、彻底干燥 D、加点铁粉4. 下列烷烃命名错误的是( )A、2─甲基戊烷 B、3─乙基戊烷 C、3,4─二甲基戊烷 D、3─甲基己烷5. 下列物质溶于水时会破坏水的电离平衡,且属于电解质的是( )
A、氯气 B、二氧化碳 C、氯化钾 D、醋酸钠6. 下列变化过程中Q>0的是( )A、CH3COOH CH3COO- + H+ + Q B、CaCO3(s)→ CaO(s)+ CO2(g)+ Q C、S2- + H2O HS- + OH- + Q D、S(g)→S(l)+ Q7. 下列有关有机物结构、性质的分析正确的是( )A、苯可以在空气中燃烧,但不能使酸性高锰酸钾溶液褪色 B、乙烯和苯都能与 H 2 发生加成反应,说明二者均含有碳碳双键 C、乙醇、乙酸均能与 Na 反应放出 H 2 , 二者分子中官能团相同 D、乙醇在铜催化作用下,能发生还原反应生成乙醛8. 铁棒与石墨用导线连接后,浸入0.01mol·L-1的食盐溶液中(如图所示),下列说法正确的是( ) A、铁棒是阴极 B、石墨附近产生OH- C、石墨上有Cl2 放出 D、铁棒上有H2放出9. 下列试剂或方法肯定不能鉴别氯化钠和氯化铵固体的是( )A、观察颜色 B、加热 C、加水 D、加紫色石蕊试液10. 标准状况下的1mol N2和1mol13C2H2 , 下列叙述错误的是( )A、质量相等 B、体积相等 C、质子数相等 D、共用电子对数目相等11. 下列变化不能通过一步反应直接完成的是( )A、Na→Na2O2 B、C→CO2 C、S→SO3 D、Fe→Fe3O412. 测定硫酸铜晶体中结晶水含量的实验中,下列哪个仪器是不需要的( )
A、铁棒是阴极 B、石墨附近产生OH- C、石墨上有Cl2 放出 D、铁棒上有H2放出9. 下列试剂或方法肯定不能鉴别氯化钠和氯化铵固体的是( )A、观察颜色 B、加热 C、加水 D、加紫色石蕊试液10. 标准状况下的1mol N2和1mol13C2H2 , 下列叙述错误的是( )A、质量相等 B、体积相等 C、质子数相等 D、共用电子对数目相等11. 下列变化不能通过一步反应直接完成的是( )A、Na→Na2O2 B、C→CO2 C、S→SO3 D、Fe→Fe3O412. 测定硫酸铜晶体中结晶水含量的实验中,下列哪个仪器是不需要的( )
A、蒸发皿 B、研钵 C、干燥器 D、坩埚13. 与实际化工生产功能相符合的化学方程式是( )A、工业制取乙烯: C2H5OH CH2=CH2↑+H2O B、工业合成盐酸:H2 + Cl2 2HCl C、工业获取氯化钠:2Na + Cl2 2NaCl D、工业制漂粉精:2Ca(OH)2+2Cl2 → Ca(ClO)2+CaCl2+2H2O14. 如图是可逆反应A+2B 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是( )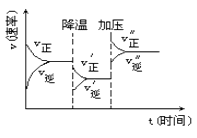 A、正反应是放热反应 B、A,B一定都是气体 C、D一定不是气体 D、C可能是气体15. 下列物质之间进行反应时,可用离子方程式2H+ + CO32- → H2O+CO2 ↑表示的是( )A、碳酸钠溶液中加入足量醋酸溶液 B、碳酸钡和稀硝酸反应 C、碳酸氢钠溶液中加入少量稀硫酸 D、在盐酸溶液中滴入少量碳酸钾溶液16. 将二氧化硫气体通入KIO3淀粉溶液,溶液先变蓝后褪色。此过程中二氧化硫表现出( )A、酸性 B、还原性 C、氧化性 D、漂白性17. 常温下,若HA溶液和NaOH溶液混合后pH=7,下列说法错误的是( )A、反应后HA溶液可能有剩余 B、HA溶液和NaOH溶液的体积可能相等 C、溶液中c(Na+)>c( A-) D、HA溶液的c(H+)和NaOH溶液的c(OH-)可能不相等18. 根据相关化学原理,下列判断正确的是:( )A、若R
A、正反应是放热反应 B、A,B一定都是气体 C、D一定不是气体 D、C可能是气体15. 下列物质之间进行反应时,可用离子方程式2H+ + CO32- → H2O+CO2 ↑表示的是( )A、碳酸钠溶液中加入足量醋酸溶液 B、碳酸钡和稀硝酸反应 C、碳酸氢钠溶液中加入少量稀硫酸 D、在盐酸溶液中滴入少量碳酸钾溶液16. 将二氧化硫气体通入KIO3淀粉溶液,溶液先变蓝后褪色。此过程中二氧化硫表现出( )A、酸性 B、还原性 C、氧化性 D、漂白性17. 常温下,若HA溶液和NaOH溶液混合后pH=7,下列说法错误的是( )A、反应后HA溶液可能有剩余 B、HA溶液和NaOH溶液的体积可能相等 C、溶液中c(Na+)>c( A-) D、HA溶液的c(H+)和NaOH溶液的c(OH-)可能不相等18. 根据相关化学原理,下列判断正确的是:( )A、若R 和M
和M  的电子层结构相同,则原子序数: M> R
B、若R
的电子层结构相同,则原子序数: M> R
B、若R  和M
和M  的电子层结构相同,则离子半径:M
的电子层结构相同,则离子半径:M  >R
>R  C、若X是原子晶体,Y是分子晶体,则熔点:Y>X
D、若A2+2D-→2A-+D2 , 则氧化性:D->A-
19. 下列各组离子,能在同种溶液中大量共存的是( )A、NH4+、Na+、OH-、SO42- B、NH4+、Mg2+、NO3- 、Cl- C、Ba2+、OH-、Cl-、SO42- D、Fe2 +、H+ 、Cl- 、NO3-20. 在0.1 mol/L Na2CO3溶液中,微粒间浓度关系正确的是( )
C、若X是原子晶体,Y是分子晶体,则熔点:Y>X
D、若A2+2D-→2A-+D2 , 则氧化性:D->A-
19. 下列各组离子,能在同种溶液中大量共存的是( )A、NH4+、Na+、OH-、SO42- B、NH4+、Mg2+、NO3- 、Cl- C、Ba2+、OH-、Cl-、SO42- D、Fe2 +、H+ 、Cl- 、NO3-20. 在0.1 mol/L Na2CO3溶液中,微粒间浓度关系正确的是( )
A、[Na+] + [H+]=[OH-] + [HCO3-] + [CO32-] B、[Na+]>[CO32-]>[HCO3-]>[OH-] C、[Na+]=2[CO32-] + 2[HCO3-] + 2[H2CO3] D、[Na+]>[HCO3-]>[CO32-]>[OH-]二、综合题
-
21. 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
I. 利用反应:6NO2 + 8NH3 7N2 + 12 H2O处理NO2。
II. 一定条件下NO2与SO2可发生反应:NO2(g)+SO2(g) SO3(g)+NO(g) −Q (Q>0) 。
III. CO可用于合成甲醇,反应方程式为:CO(g) + 2H2(g) CH3OH(g) 。
(1)、硫离子最外层电子的电子排布式为 , 氨气分子的电子式为 , 氨气分子属于分子(填“极性”或者“非极性”)。(2)、C、O、S、N这四种元素中属于同周期元素的非金属性由强到弱的顺序为 , 能证明其递变规律的事实是()a、最高价氧化物对应水化物的酸性 b、气态氢化物的沸点
c、单质与氢气反应的难易程度 d、其两两组合形成的化合物中元素的化合价
(3)、对于I中的反应,120℃时,该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2) =。(4)、对于II中的反应,将NO2与SO2以体积比1:2置于密闭容器中反应,下列能说明反应达到平衡状态的是a. 体系压强保持不变
b. NO2浓度保持不变
c. NO2和SO3的体积比保持不变
d. 混合气体的平均相对分子质量保持不变
(5)、请写出II中反应的平衡常数表达式K=。如果II中反应的平衡常数K值变大,该反应a.一定向正反应方向移动
b. 平衡移动时,正反应速率先减小后增大
c.一定向逆反应方向移动
d. 平衡移动时,逆反应速率先增大后减小
(6)、对于III中的反应,CO在不同温度下的平衡转化率与压强的关系如图示。
实际生产条件控制在250℃、1.3×104 kPa左右,简述选择此压强的理由:。
22. 海洋是资源的宝库,含有丰富的化学元素。(1)、在电解饱和食盐水的实验中,阳极产物的检验方法是。(2)、目前从海水中提溴(Br 2 )大致有以下步骤。①向浓缩的海水中通入Cl2 , 将海水中的 Br- 氧化为 Br2 。
②用热空气将 Br 2 从上述溶液中吹出,并由浓 Na 2 CO 3 溶液吸收,转变为 NaBr、NaBrO 3和CO2 。吸收1 moL Br 2 需消耗 Na2CO3 moL。
③再将所得混合溶液用稀硫酸酸化,得到浓度较高的溴水,配平该反应的离子方程式。
Br-+ BrO3- +H + → Br2 +H2O
(3)、碘主要从海带中提取,某课外兴趣小组的同学用海带为原料制得少量碘水之后,欲用CCl4从碘水中萃取碘,请简述能用CCl4从碘水中萃取碘的原因是:。(4)、同温同浓度的Na2CO3溶液、NaHCO3溶液,PH大小顺序为˃。NaHCO3溶液中滴入少量氢氧化钠溶液,溶液中c(CO32-)(填变大或变小),请用平衡理论解释发生这种变化的原因。23. 联碱法(侯氏制碱法)和氨碱法的生产流程简要表示如下图: (1)、两种方法的沉淀池中均发生的反应化学方程式为。(2)、X是 , Y是(填化学式)。(3)、Z中除了溶解的氨气、食盐外,其它溶质还有;排出液中的溶质除了氢氧化钙外,还有。(4)、根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是。
(1)、两种方法的沉淀池中均发生的反应化学方程式为。(2)、X是 , Y是(填化学式)。(3)、Z中除了溶解的氨气、食盐外,其它溶质还有;排出液中的溶质除了氢氧化钙外,还有。(4)、根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是。a.常温时氯化铵的溶解度比氯化钠小
b.通入氨气能增大NH4+的浓度,使氯化铵更多析出
c.加入食盐细粉能提高Na+的浓度, 使NaHCO3结晶析出
(5)、为检验产品碳酸钠中是否含有氯化钠,请设计实验方案。(6)、联碱法中,每当通入NH3 22.4L(已折合成标准状况下)时可以得到纯碱50.0g,则NH3的利用率为。(结果精确到0.01)24. 有机物E是医药合成中间体。其合成路线如下: (1)、
(1)、 的官能团名称为。E的分子式为。 (2)、B→D的过程中,B分子的羧基全部酯化,写出该反应方程式:。(3)、D→E的反应历程如下:
的官能团名称为。E的分子式为。 (2)、B→D的过程中,B分子的羧基全部酯化,写出该反应方程式:。(3)、D→E的反应历程如下:
写出反应Ⅱ、Ⅲ的反应类型:Ⅱ、Ⅲ
(4)、写出满足下列条件的A的所有同分异构体的结构简式。a.能与新制氢氧化铜悬浊液反应产生砖红色沉淀
b.常温下能与Na2CO3反应并释放出气体
(5)、请写出以CH2=CH2为主要原料(无机试剂任用)制备OHC—CHO(乙二醛)的合成路线流程图(须注明反应条件)。(合成路线常用的表示方式为:A B…… 目标产物)