山西省晋城市2017-2018学年高考理综-化学一模考试试卷
试卷更新日期:2018-05-24 类型:高考模拟
一、单选题
-
1. 下列生活用品与其主要成分对应正确的是( )A、煤炭——单质碳 B、常用食品包装袋——聚苯乙烯 C、肥皂——高级脂肪酸钠 D、明矾——十二水合硫酸铝2. 下列化学用语表述正确的是( )
A、核内质子数为117,核内中子数为174的核素Ts可表示为: B、乙醇的结构简式:C2H6O C、COCl2的结构式为: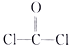 D、CaO2的电子式为:
D、CaO2的电子式为:  3. 已知2X(g)+2Y(g) 3Z(g)+W(g)△H的能量变化如图所示。下列说法正确的是( )
3. 已知2X(g)+2Y(g) 3Z(g)+W(g)△H的能量变化如图所示。下列说法正确的是( ) A、△H=E2-E1 B、正反应的活化能等于E3 C、加入高效催化剂,△H减小 D、恒压下充入一定量的氦气,n(Z)不变4. 下列指定反应的离子方程式正确的是( )A、向偏铝酸钠和碳酸钠的混合溶液中滴加少量盐酸:AlO2-+ H++H2O=Al(OH)3 ↓ B、将少量SO2 通入次氯酸钠溶液:ClO-+SO2+H2O=2H++Cl-+SO42- C、向碘化亚铁溶液中滴加少量稀硝酸:NO3-+3Fe2++4H+=3Fe3++ NO↑+2H2O D、向氯化铝溶液中滴加硫化钠溶液:3S2-+2Al3+=Al2S3↓5. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、常温常压下,3.2g肼(N2H4)中含有的共价键数目为0.4NA B、标准状况下,4.48LCO2和N2O的混合气体中含有的电子数为4.4NA C、0.5L0.5mol·L-1醋酸溶液中含有的分子数目小于0.25NA D、常温常压下,NaH与水反应产生2g氢气时,转移电子数为2NA6. 对下列各实验装置的描述正确的是( )A、
A、△H=E2-E1 B、正反应的活化能等于E3 C、加入高效催化剂,△H减小 D、恒压下充入一定量的氦气,n(Z)不变4. 下列指定反应的离子方程式正确的是( )A、向偏铝酸钠和碳酸钠的混合溶液中滴加少量盐酸:AlO2-+ H++H2O=Al(OH)3 ↓ B、将少量SO2 通入次氯酸钠溶液:ClO-+SO2+H2O=2H++Cl-+SO42- C、向碘化亚铁溶液中滴加少量稀硝酸:NO3-+3Fe2++4H+=3Fe3++ NO↑+2H2O D、向氯化铝溶液中滴加硫化钠溶液:3S2-+2Al3+=Al2S3↓5. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、常温常压下,3.2g肼(N2H4)中含有的共价键数目为0.4NA B、标准状况下,4.48LCO2和N2O的混合气体中含有的电子数为4.4NA C、0.5L0.5mol·L-1醋酸溶液中含有的分子数目小于0.25NA D、常温常压下,NaH与水反应产生2g氢气时,转移电子数为2NA6. 对下列各实验装置的描述正确的是( )A、 甲装置可用来模拟工业制取NaHCO3 , 实验时为防止倒吸,应先通入CO2一段时间后再通NH3
B、
甲装置可用来模拟工业制取NaHCO3 , 实验时为防止倒吸,应先通入CO2一段时间后再通NH3
B、 乙装置可用来萃取溴水中的溴,放出下层水后,另换洁净的烧怀放出有机层
C、
乙装置可用来萃取溴水中的溴,放出下层水后,另换洁净的烧怀放出有机层
C、 丙装置可用来分离四氯化碳和苯的混合物,其中直形冷凝管可用球形冷凝管代替
D、
丙装置可用来分离四氯化碳和苯的混合物,其中直形冷凝管可用球形冷凝管代替
D、 丁装置可用来做喷泉实验,若在水中滴入少量酚酞,实验中可观察到红色喷泉
7. 下列关于有机物的说法正确的是( )A、分子式为C5H12O且能与Na反应生成H2的有机物其8种 B、乙二醇和丙三醇互为同系物 C、由氯乙烯生成聚氯乙烯和由氨基酸生成蛋白质的反应都属于加聚反应 D、一定条件下,蔗糖既可以发生水解反应,又可以发生银镜反应8. 分子式为C8H8O2 , 且能与饱和NaHCO3溶液放出气体的芳香族化合物共有(不含立体异构)( )A、6种 B、5种 C、4种 D、3种9. 下列实验方案、现象和结论都合理的是( )
丁装置可用来做喷泉实验,若在水中滴入少量酚酞,实验中可观察到红色喷泉
7. 下列关于有机物的说法正确的是( )A、分子式为C5H12O且能与Na反应生成H2的有机物其8种 B、乙二醇和丙三醇互为同系物 C、由氯乙烯生成聚氯乙烯和由氨基酸生成蛋白质的反应都属于加聚反应 D、一定条件下,蔗糖既可以发生水解反应,又可以发生银镜反应8. 分子式为C8H8O2 , 且能与饱和NaHCO3溶液放出气体的芳香族化合物共有(不含立体异构)( )A、6种 B、5种 C、4种 D、3种9. 下列实验方案、现象和结论都合理的是( )实验目的
实验方案、现象
结论
A
检验溶液中有无NH4+
用试管取少量的待检测溶液,加入少量的稀NaOH溶液,用一块湿润的红色石蕊试纸放在试管口
若试纸变蓝,则有
NH4+ , 否则无NH4+
B
检验溶液中有无K+
用洁净的铂丝蘸取待测液进行焰色反应,火焰呈黄色
原溶液中一定无K+
C
检验溶液中有无SO42-
用试管取少量的待检测溶液,加入稀盐酸无现象,再加入BaCl2溶液,出现白色沉淀
原溶液中有SO42-
D
检验淀粉水解产物有无还原性
用试管取少量的淀粉溶液加入适量的稀硫酸,加热一段时间后,加入少量的新制Cu(OH)2悬浊液,加热至沸腾,产生大量的砖红色沉淀
水解产物有还原性
A、A B、B C、C D、D10. 短周期元素A、B、C、D的原子序数依次增大,B和C为同周期的金属元素,A和B的最外层电子数之和等于D元素原子的最外层电子数,A、B、C、D四种元素最高价氧化物对应的水化物分别为甲、乙、丙、丁,他们之间存在如图所示的反应关系(图中用“—“相连的两种物质间可发生反应),下列说法正确的是( ) A、简单离子半径大小顺序:D>B>A>C B、等物质的量的BA3和B3A中含有的阴阳离子总数相等 C、元素A和D的简单氢化物分子间仅存在范德华力 D、元素B和D形成化合物的水溶液呈碱性11. A、B、C、D、E 五种物质中均含有同一种短周期主族元素R, 它们能发生如图所示的转化关系,已知A、B、D、E四种物质均难溶于水,单质R能与NaOH溶液反应生成盐和氢气。
A、简单离子半径大小顺序:D>B>A>C B、等物质的量的BA3和B3A中含有的阴阳离子总数相等 C、元素A和D的简单氢化物分子间仅存在范德华力 D、元素B和D形成化合物的水溶液呈碱性11. A、B、C、D、E 五种物质中均含有同一种短周期主族元素R, 它们能发生如图所示的转化关系,已知A、B、D、E四种物质均难溶于水,单质R能与NaOH溶液反应生成盐和氢气。
下列说法正确的是( )
A、反应①中氧化剂与还原剂的物质的量之比为1∶1 B、化合物A既能溶于NaOH又能溶于氢氟酸 C、反应④的离子方程式为:2R+2OH-+2H2O=2RO2-+3H2↑ D、化合物C的溶液与反应①产生的气体能够发生化学反应12. 在体积均为1.0L的两个恒容密闭容器中加入足量的相同质量的固体B,再分别加入0.1molA和0.2molA,在不同温度下反应A(g)+B(s) 2C(g)达到平衡,平衡时A的物质的量浓度c(A)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是( ) A、反应A(g)+B(s) 2C(g)△S>0、△H<0 B、A的转化率:a(状态Ⅱ)>a(状态Ⅲ) C、体系中c(C)∶c(C,状态Ⅱ)>(C,状态Ⅲ) D、化学平衡常数:K(状态Ⅰ)=K(状态Ⅲ)>K(状态Ⅱ)13. 某化学活动小组利用如图装置对电化学进行探究,开始两电极质量相等,下列说法正确的是( )
A、反应A(g)+B(s) 2C(g)△S>0、△H<0 B、A的转化率:a(状态Ⅱ)>a(状态Ⅲ) C、体系中c(C)∶c(C,状态Ⅱ)>(C,状态Ⅲ) D、化学平衡常数:K(状态Ⅰ)=K(状态Ⅲ)>K(状态Ⅱ)13. 某化学活动小组利用如图装置对电化学进行探究,开始两电极质量相等,下列说法正确的是( ) A、若X为铜片,左池发生吸氧腐蚀作原电池,X在右池的电极反应式为Cu-2e-=Cu2+ B、若X装载的是足量饱和KCl溶液浸泡的琼脂,当外电路通过0.02mol电子时,两电极的质量差为0.64g C、若X装载的是足量饱和KCl洛液浸泡的琼脂,则X中的K+移向左池 D、若X为锌片,左池为电池的负极区14. 25℃时,用pH计测量VmL0.1mol·L-1NaOH溶液中逐滴滴加等浓度的一元酸HA后pH的变化情况,绘制pH变化曲线如图所示,下列说法错误的是( )
A、若X为铜片,左池发生吸氧腐蚀作原电池,X在右池的电极反应式为Cu-2e-=Cu2+ B、若X装载的是足量饱和KCl溶液浸泡的琼脂,当外电路通过0.02mol电子时,两电极的质量差为0.64g C、若X装载的是足量饱和KCl洛液浸泡的琼脂,则X中的K+移向左池 D、若X为锌片,左池为电池的负极区14. 25℃时,用pH计测量VmL0.1mol·L-1NaOH溶液中逐滴滴加等浓度的一元酸HA后pH的变化情况,绘制pH变化曲线如图所示,下列说法错误的是( ) A、A点溶液的pH=13 B、B和C两点所示溶液中水的电离程度:B>C C、pH=7时,溶液中存在:c(Na+)=c(H+)+(HA) D、C点所示溶液中离子浓度大小顺序:c(A-)>c(Na+)>c(H+)>c(OH-)15. 已知p(A)=-lgc(A),三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
A、A点溶液的pH=13 B、B和C两点所示溶液中水的电离程度:B>C C、pH=7时,溶液中存在:c(Na+)=c(H+)+(HA) D、C点所示溶液中离子浓度大小顺序:c(A-)>c(Na+)>c(H+)>c(OH-)15. 已知p(A)=-lgc(A),三种金属硫化物在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( ) A、a点无MnS沉淀生成 B、CuS和MnS的悬浊液中,c(Cu2+)/c(Mn2+)=10-20 C、向MnS悬浊液中加入少量CuCl2固体,c(Mn2+) 减小 D、向含等浓度ZnCl2 和CuCl2的溶液中逐滴加入饱和Na2S溶液,先析出的是ZnS
A、a点无MnS沉淀生成 B、CuS和MnS的悬浊液中,c(Cu2+)/c(Mn2+)=10-20 C、向MnS悬浊液中加入少量CuCl2固体,c(Mn2+) 减小 D、向含等浓度ZnCl2 和CuCl2的溶液中逐滴加入饱和Na2S溶液,先析出的是ZnS二、实验题
-
16. 氨基甲酸铵是一种重要化工产品,常温时,为白色晶体或粉末,易溶于水,难溶于CCl4 , 59℃时分解为氨及二氧化碳,其制备原理:2NH3(g)+CO2(g) NH2COONH4 (s) △H=-272kJ·mol-1。某化学兴趣小组利用下图实验装置(部分固定装置已省略)模拟制备NH2COONH4。试回答下列问题:
 (1)、仪器组装完毕后,首先应进行的操作是。(2)、装置A用于实验室制取NH2COONH4的原料气体之一,该反应的化学方程式为。
(1)、仪器组装完毕后,首先应进行的操作是。(2)、装置A用于实验室制取NH2COONH4的原料气体之一,该反应的化学方程式为。
(3)、装置F中试剂的名称为 , 装置G的作用为。(4)、为提高原料气的利用率,应控制装置C和E中最佳鼓泡速率比为 , 装置D采用冰水浴的原因为。(5)、生成的氨基甲酸铵悬浮于CCl4 中,下列操作可实现产品分离的是。


 (6)、实验装置中存在明显不足之处的是 , 有同学认为装置H、G和F组成的装置过于复杂可简化,请简述该方法:。17. 亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
(6)、实验装置中存在明显不足之处的是 , 有同学认为装置H、G和F组成的装置过于复杂可简化,请简述该方法:。17. 亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
(1)、(一)利用下列装置制备NaNO2。已知:①2NO+Na2O2=2NaNO2;② NO和NO2-均能被酸性高锰酸钾氧化为NO3-。

选择上述仪器完成实验,其连按顺序为(按气流方向,用小写字母表示)。
(2)、装置A中m管的作用为。(3)、装置B中发生反应的离子方程式为。(4)、(二)测定上述实验所制备的NaNO2样品(含NaNO3和Na2CO3 杂质)的纯度。称量D中所得样品ag溶解后配制成250 mL 溶液,取25.00mL于锥形瓶用6mol·L-1 的酸性高锰酸钾溶液滴定到终点;重复上述滴定操作两次,测得数据如下表:
第一次
第二次
第三次
酸性高锰酸钾溶液体积/mL
19.98
19.75
20.02
盛装酸性高锰酸钾溶液前需对酸式滴定管进行的操作为。
(5)、滴定到终点的实验现象为。(6)、下列实验操作可能导致出现上表中第二次实验数据的是(填字母编号)。a.滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外
b.加入样品溶液前的锥形瓶未经干燥
c.滴定前仰视读数,滴定后俯视读数
(7)、最终所得样品中NaNO2 的质量分数为(用含a、b的关系式表示)。三、综合题
-
18. 工业上可用铬铁矿(主要成分可表示为FeO·Cr 2O3 , 还含有Al2O3、MgCO3、SiO2 等杂质)为原料制备重铬酸钾晶体和绿矾的流程如下:

已知:Ⅰ.常见离子沉淀的pH范围
Fe3+
Al3+
Mg2+
SiO32-
AlO2-
开始沉淀
1.9
4.2
8.1
9.5
10.2
沉淀完全
3.2
5.3
9.4
8.0
8.5
Ⅱ.焙烧过程中主要发生反应:2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2Cr2O4+Fe2O3+ 4CO2 ↑+7NaNO2。
(1)、绿矾的化学式为。(2)、焙烧后的混合物中除含有Na2Cr2O4、NaNO2和过量的Na2CO3、NaNO3外,还含有NaAlO2和Na2SiO3等物质,则焙烧过程中NaAlO2的化学方程式为。(3)、固体Y的主要成分为(填写化学式)。(4)、酸化过程中用醋酸调节pH=5的目的为;若pH调节的过低,NO2-可被氧化为NO3- , 其离子方程式为。(5)、调节pH=5后,加入KCl 控制一定条件,可析出K2Cr2O7晶体,说明溶解度的大小:K2Cr2O7Na2Cr2O7(填“大于”或“小于”)。(6)、流程中的一系列操作为。19. 一定条件下正丁烷(CH3CH2CH2CH3)易发生两种裂解反应:Ⅰ.CH3CH2CH2CH3 (g) CH3CH=CH2(g)+CH4(g) △H1=+ 61.31 kJ·mol-1
Ⅱ.CH3CH2CH2CH3(g) CH2=CH2(g)+CH3CH3(g) △H2=-56.00 kJ·mol-1
(1)、维持体系温度T不变,总压p恒定时,体积为V1 L的正丁烷发生裂解反应,一段时间平衡后气体体积变为V2 L,此时正丁烷的转化率a(正丁烷)=;维持体系温度不变,向体系中充入一定量的水蒸气(水蒸气在该条件下不参与反应),再次平衡后正丁烷的转化率将(填“增大”、“不变”或“减小”),原因为。(2)、一定温度下向体积为2L的密闭容器中充入0.2molCH3CH=CH2和0.5 molCH4发生反应CH3CH=CH2(g) +CH4(g) CH2=CH2(g)+CH3CH3(g) △H3;5 min后达到平衡状态,容器内剩余CH3CH =CH2的物质的量为0.1mol。①△H3=。
②5min内该反应的反应速率v(CH4)=。
③保持温度不变,向某密闭容器中充入等物质的量的CH3CH =CH2和CH4 , 平衡后容器内CH4的体积分数为。
(3)、将0.1molCH2=CH2完全燃烧后的气体通入100mL一定浓度的NaOH溶液中,并将所得溶液稀释至1L。最终所得溶液中CO32-、HCO3-、H2CO3 三者所占物质的量分数随原NaOH溶液浓度变化的关系如图所示:
其中图中表示原氢氧化钠溶液浓度为3mol·L-1的是(选填“a”、“b”、“c”、“d”或“e” ),
(4)、以氢氧化钠溶液为电解质溶液,CH2=CH2 燃料电池的负极反应式为。