辽宁省大连市2017-2018学年高考理综-化学一模考试试卷
试卷更新日期:2018-05-23 类型:高考模拟
一、单选题
-
1. 中国传统文化对人类文明贡献巨大。下列古代文献涉及的化学研究成果,对其说明不合理的是( )A、《天工开物》中“凡石灰,经火焚炼为用”里的“石灰”是指CaO B、《黄白第十大》中“曾青涂铁,铁赤如铜”主要发生了置换反应 C、《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露”,利用到蒸馏 D、《梦溪笔谈》中“以剂钢为刃,柔铁为茎干,不尔则多断折”中的剂钢是指铁的合金2. 洁厕灵和84消毒液混合使用会发生反应: NaClO+2HCl=NaCl+Cl2↑+H2O,生成有毒的氯气。下列说法正确的是( )A、每生成1mol氯气,转移的电子数为2NA B、1 mol NaCl含有的电子数为28NA C、1L0.2mol/ L NaClO溶液中含有的次氯酸根离子数为0.2NA D、标准状况下,将22.4L HCl溶解在0.5L水中,形成2mol/L的盐酸3. 下列关于有机物的说法错误的是( )A、苯和乙烯均可以使溴水褪色,但褪色原理不同 B、等物质的量的乙烯与乙醇完全燃烧消耗氧气的物质的量相等 C、向制备乙酸乙酯后剩余的反应液中加入碳酸钠溶液,产生气泡,说明有乙酸剩余 D、在C4H11N分子中,N原子以三个单键与其他原子相连接的同分异构体有8种(不考虑立体异构)4. W、X、Y、Z为四种短周期主族元素,它们在元素周期表中的相对位置如下图所示,其中Y原子的最外层电子数是其电子层数的2倍。下列说法正确的是( )
 A、W单质比X单质更易与氢气化合 B、W的最高价含氧酸可用于制取氢气 C、元素X和钠形成的化合物只含有离子键 D、简单离子半径大小关系为:Y>Z>W>X5. 下列实验操作、现象和结论均正确的是( )
A、W单质比X单质更易与氢气化合 B、W的最高价含氧酸可用于制取氢气 C、元素X和钠形成的化合物只含有离子键 D、简单离子半径大小关系为:Y>Z>W>X5. 下列实验操作、现象和结论均正确的是( )实验操作
现象
结论
A
将少量的饱和硼酸溶液滴加到碳酸钠溶液中
无气泡
Ka2H2 CO3>H3BO3
B
向蔗糖溶液中加入稀硫酸并水浴加热,一段时间后再向混合液中加入新制备的Cu(OH)2悬浊液并加热
无红色沉淀
蔗糖未水解
C
将浸透了石蜡油的石棉放置在硬质试管底部,加入少量碎瓷片,并加强热,将生成的气体通入酸性高锰酸钾溶液
溶液褪色
石蜡油分解产物中含有不饱和烃
D
向1mL2mol/L的NaOH溶液中,滴加1-2滴1mol/ L MgCl2溶液,再滴加2滴1mol/ L FeCl3溶液
先有白色沉淀,后有红褐色沉淀
Ksp:Mg(OH)2>Fe(OH)3
A、A B、B C、C D、D6. 微生物燃料电池在净化废水(主要去除Cr2O72-)的同时能获得能源或得到有价值的化学产品。如图为其工作原理,如图为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是( )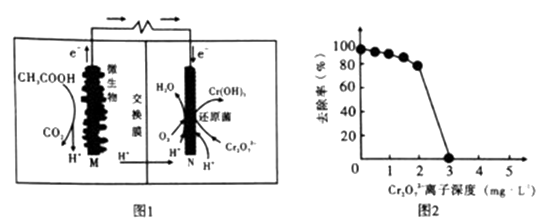 A、M为电池正极,CH3COOH被还原 B、外电路转移4mol电子时,M极产生22.4LCO2(忽略CO2溶解) C、反应一段时间后,N极附近pH下降 D、Cr2O72-离子浓度较大时,可能会造成还原菌失活7. 已知:对于电离常数为Ka的某一元弱酸,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法错误的是( )
A、M为电池正极,CH3COOH被还原 B、外电路转移4mol电子时,M极产生22.4LCO2(忽略CO2溶解) C、反应一段时间后,N极附近pH下降 D、Cr2O72-离子浓度较大时,可能会造成还原菌失活7. 已知:对于电离常数为Ka的某一元弱酸,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法错误的是( ) A、由图可知:c1>c2>c3 B、M点溶液中存在:c(H+)+c(HA)=c(OHˉ)+c(Aˉ) C、恰好中和时,溶液中离子浓度的大小关系:c(Na+)>C(Aˉ ) >C(OHˉ )>c(H+) D、计算可知HA的电离常数:Ka=
A、由图可知:c1>c2>c3 B、M点溶液中存在:c(H+)+c(HA)=c(OHˉ)+c(Aˉ) C、恰好中和时,溶液中离子浓度的大小关系:c(Na+)>C(Aˉ ) >C(OHˉ )>c(H+) D、计算可知HA的电离常数:Ka=二、综合题
-
8. 铅及其化合物有着优异的性能和广泛的应用。工业上利用铅浮渣(主要成分是PbO、Pb,还含有少量的Ag、CaO)制备硫酸铅。制备流程图如下
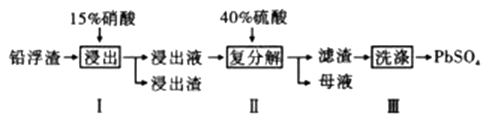
已知:Ksp(PbSO4)=1.6×10-8 Ksp(CaSO4)=4.9×10-5
(1)、步骤I有NO产生浸出液中含量最多的金属阳离子为Pb2+ , 写出Pb参加反应的化学方程式 , 为防止Ag被溶解进入溶液,步骤I操作时应注意。(2)、粗PbSO4产品含有的杂质是;要得到纯净的PbSO4 , 需要用试剂进行多次洗涤,再用蒸馏水洗涤。最好选用的试剂是。A.稀硫酸
B.稀盐酸
C.硝酸铅溶液
D.酒精
(3)、母液可循环利用的物质是HNO3 , 若母液中残留的SO42-过多,循环利用时可能出现的问题是。(4)、若将步骤Ⅱ中的Pb2+完全沉淀,则溶液中的c(SO42-)至少为mol/L。(5)、(CH3COO)2Pb是皮毛行业可溶于水的染色助剂,可用PbSO4与CH3 COONH4反应制备,写出该反应的离子方程式。(6)、铅蓄电池是电压稳定、使用方便的二次电池。PbSO4在其中扮演了重要角色,写出铅蓄电池充电时阳极的电极反应。9. 氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。
(1)、写出NH2Cl的电子式。(2)、写出NH2Cl与水反应的化学方程式。
(3)、一定条件下(T℃、1.01×105Pa),可以用Cl2(g)和NH3(g)制得NH2Cl(g),同时得到HCl(g)。已知部分化学键的键能如下表:
写出该反应的热化学方程式。
(4)、Ⅱ.亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在一定条件下合成:2NO(g)+Cl2(g) 2NOCl(g) △H<0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比 进行反应,平衡时某反应物的转化率与氮氯比及不同温度的关系如图所示: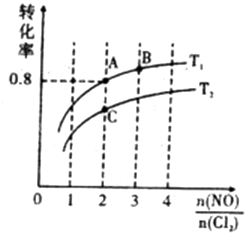
图中T1、T2的关系为:T1T2 (填“>”、“<”或“=”)
(5)、图中纵坐标为物质的转化率,理由为。(6)、图中A,B,C三点对应的NOCl体积分数最大的是(填“A”、“B”、或“C”)。(7)、若容器容积为1L,则B点的平衡常数为。10. [化学——选修3:物质结构与性质]碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:(1)、碳原子的价电子排布式 , 核外有种不同运动状态的电子。(2)、碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。
①嘌呤中所有元素的电负性由大到小的顺序。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因。
③吡啶结构中N原子的杂化方式。
④分子中的大π键可用符号π 表示,m代表形成大π键的原子数,n代表参与形成大π键的电子数。则吡啶结构中的大π键表示为。
(3)、碳元素能形成CO、CO2、H2CO3等多种无机化合物。①二氧化碳的晶体叫做干冰,每个二氧化碳分子周围通常有个紧邻的分子。
②在CO转化成CO2的反应过程中,下列说法正确的是。
A.分子中孤电子对数不变
B.分子的极性发生变化
C.原子间成键方式发生改变
D.分子晶体的熔沸点升高
③H2CO3与H3PO4均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因。
(4)、2017年,中外科学家团队共同合成了碳的一种新型同素异形体:T-碳。T-碳的结构是将立方金刚石中的每个碳原子用一个由4个碳原子组成的正四面体结构单元取代形成碳的一种新型三维立方晶体结构,如下图。已知T碳晶胞参数为a pm,阿伏加德罗常数为NA , 则T碳的密度的表达式为g/cm3。(写出表达式即可) 11. [化学——选修5:有机化学基础]
11. [化学——选修5:有机化学基础]聚对萃二甲酸乙二醇酯(PET俗称涤纶树脂,是一种重要的有机高分子材料。其结构为
 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示:
根据题意回答下列问题:
(1)、B的化学名称是 , C所含官能团的名称是。(2)、由1,3-丁二烯可制备顺式聚1,3-丁二烯,写出顺式聚1,3-丁二烯的结构简式:。(3)、A→D、B→C的反应类型分别为、。(4)、写出C+F→PET的化学反应方程式。(5)、G是F的同系物,其相对分子质量比F多28,G的核磁共振氢谱有三组峰,峰面积比为3︰1︰1,则符合该条件的G的同分异构体共有种,写出其中一种结构简式。(6)、参照上述合成路线,以1,3-丁二烯为原料(无机试剂任选),设计制备丁苯橡胶
三、实验题
-
12. I.某学习小组设计如下图装置制取SO2 , 研究其性质,并进一步探究不同浓度硫酸的氧化性
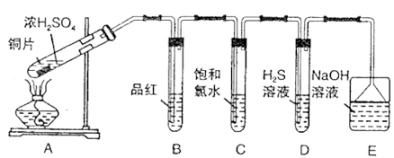
请回答下列问题:
(1)、B、C、D分别用于检验SO2的性质,写出C中反应的离子方程式。(2)、实验中观察到D中有浑浊出现,有同学提出此现象不能证明SO2具有氧化性。请简述理由:。
(3)、E装置的作用为。(4)、Ⅱ.某学习小组设计并完成如下实验:称取一定量的还原铁粉放入一定体积的浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y中含有SO2、H2。)溶液X中一定大量含有的金属阳离子是 , 简述如何检验溶液X中该离子。
(5)、为了测定气体Y中SO2的含量,将2.24L(标准状况)气体Y通入到200.00mL 0.2000mol/L酸性高锰酸钾溶液中,充分反应后,取出20.00mL溶液转入锥形瓶中进行滴定,消耗浓度为0.0500mol/L的KHC2O4标准液20.00mL。①室温下,0.05mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4)。滴定操作时,标准液应装在
(填仪器名称)中;滴定终点的现象为。
②气体Y中SO2的物质的量分数为。