江苏省泰州市2017-2018学年高考化学一模考试试卷
试卷更新日期:2018-05-23 类型:高考模拟
一、单选题
-
1. 党的十九大报告中多次提及“绿色”、“生态文明”。下列做法不应该提倡的是( )A、分类放置生活废弃物 B、实现化石燃料清洁利用 C、使用聚碳酸酯类可降解塑料 D、大量使用化肥、农药提高粮食产量2. 下列有关化学用语表示正确的是( )A、核内有10个中子的氧原子: B、磷原子的结构示意图:
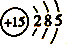 C、Na2O2的电子式:
C、Na2O2的电子式:  D、Ca(OH)2悬浊液中的溶解平衡表达式:Ca(OH)2=Ca2++2OH-
3. 下列有关物质性质与用途具有对应关系的是( )A、Al2O3熔点高,可用作耐高温材料 B、FeCl3溶液呈酸性,可用于腐蚀电路板上的Cu C、石墨具有导电性,可用于制铅笔芯 D、浓硫酸具有强氧化性,可用于干燥CO24. 下列装置应用于实验室制NO2并回收硝酸铜,能达到实验目的的是( )
D、Ca(OH)2悬浊液中的溶解平衡表达式:Ca(OH)2=Ca2++2OH-
3. 下列有关物质性质与用途具有对应关系的是( )A、Al2O3熔点高,可用作耐高温材料 B、FeCl3溶液呈酸性,可用于腐蚀电路板上的Cu C、石墨具有导电性,可用于制铅笔芯 D、浓硫酸具有强氧化性,可用于干燥CO24. 下列装置应用于实验室制NO2并回收硝酸铜,能达到实验目的的是( ) A、用装置甲制取NO B、用装置乙除NO2中的少量HNO3 C、用装置丙收集NO2 D、用装置丁蒸干Cu(NO3)2 溶液制Ca(NO3)2·6H2O5. 短周期主族元素X、Y、Z、W原子序数依次增大,X的原子半径小于Y的原子半径,Z的单质是空气中含量最高的气体,W原子最外层比Y原子最外层少1个电子,W的单质制得的金属容器常温下可盛装浓硫酸。下列说法正确的是( )A、原子半径:r(Y)<r(Z)<r(W) B、X、Y形成的化合物只含有极性键 C、Z、W的简单离子具有相同的电子层结构 D、Y的最高价氧化物的水化物酸性比Z的强6. 下列指定反应的离于方程式正确的是( )A、向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O B、浓盐酸与MnO2反应制取Cl2:MnO2+4HCl(浓) Mn2++2Cl-+Cl2↑+2H2O C、酸性条件下,碘化钾溶液露置于空气中变质:4H++4I-+O2=2I2+2H2O D、向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:HCO3-+OH-=CO32-+H2O7. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、CH3CH2Br CH3CH2OH CH3CHO B、CuO Cu(OH)2 Cu2O C、Mg(OH)2CO3 MgCl2(aq) Mg D、NaCl(aq) NaHCO3 Na2CO38. 已知: ①C6H12O6(s)=2C2H5OH(l)+2CO2(g) △H1
A、用装置甲制取NO B、用装置乙除NO2中的少量HNO3 C、用装置丙收集NO2 D、用装置丁蒸干Cu(NO3)2 溶液制Ca(NO3)2·6H2O5. 短周期主族元素X、Y、Z、W原子序数依次增大,X的原子半径小于Y的原子半径,Z的单质是空气中含量最高的气体,W原子最外层比Y原子最外层少1个电子,W的单质制得的金属容器常温下可盛装浓硫酸。下列说法正确的是( )A、原子半径:r(Y)<r(Z)<r(W) B、X、Y形成的化合物只含有极性键 C、Z、W的简单离子具有相同的电子层结构 D、Y的最高价氧化物的水化物酸性比Z的强6. 下列指定反应的离于方程式正确的是( )A、向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O B、浓盐酸与MnO2反应制取Cl2:MnO2+4HCl(浓) Mn2++2Cl-+Cl2↑+2H2O C、酸性条件下,碘化钾溶液露置于空气中变质:4H++4I-+O2=2I2+2H2O D、向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:HCO3-+OH-=CO32-+H2O7. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、CH3CH2Br CH3CH2OH CH3CHO B、CuO Cu(OH)2 Cu2O C、Mg(OH)2CO3 MgCl2(aq) Mg D、NaCl(aq) NaHCO3 Na2CO38. 已知: ①C6H12O6(s)=2C2H5OH(l)+2CO2(g) △H1②6CO2(g)+6H2O(g)=C6H12O6(s)+6O2 △H2
③2H2O(g)=2H2(g)+O2(g) △H3
④2CO2(g)+6H2(g)=C2H5OH(l)+3H2O △H4
下列有关说法正确的是( )
A、H2的燃烧热为 B、反应①使用催化剂,△H1将减小 C、标准状况下,反应②生成1.12LO2 , 转移的电子数为0.1×6.02×1023 D、2△H4=△H1+△H2-6△H39. 常温下,下列各组离子在指定溶液中可能大量共存的是( )A、澄清透明的溶液中: Fe3+、Mg2+、SCN-、Cl- B、由水电离产生的c(H+)= 10-13mol/L 的溶液: K+、Na+、CH3COO-、AlO2- C、c(Fe2+)= 1mol/L的溶液中: H+、NH4+、NO3-、SO42- D、pH= 1的溶液中: Ba2+、Mg2+、HCO3-、SO42-10. 某新型光充电电池结构如图。在太阳光照射下,TiO2光电极激发产生电子,对电池充电,Na+在两极间移动。下列说法正确的是( ) A、光充电时,化学能转变成光能 B、光充电时,电极B为阴极 C、放电时,Na+向电极A移动 D、放电时,电极B发生反应:I
A、光充电时,化学能转变成光能 B、光充电时,电极B为阴极 C、放电时,Na+向电极A移动 D、放电时,电极B发生反应:I + 2e-=3I-
11. 根据下列实验操作和现象所得到的结论正确的是( )
+ 2e-=3I-
11. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作和现象
实验结论
A
用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色
该溶液中一定不含K+
B
将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生
非金属性:Cl>Si
C
向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热,未见有银镜产生
淀粉没有水解
D
相同条件下,在两支试管中各加入4mL0.01mol/LKMnO4和2mL0.1mol/LH2C2O4 , 再向其中一支试管中快速加入少量MnSO4固体,加有MnSO4的试管中容液褪色较快
MnSO4对该反应有催化作用
A、A B、B C、C D、D12. 常温下,向20mL 浓度均为0.1mol/L (NH4)2SO4、NH4HSO4混和溶液中滴加0.1mol/L的Ba(OH)2溶液。充分反应后静置,溶液的pH 与所加Ba(OH)2溶液体积的关系如右图,下列说法正确的是( ) A、a点溶液中: c(NH4+) +c(NH3·H2O)=0.2 mol/L B、b点溶液中: c(NH4+)>c(SO42-)>c(H+)> c(NH3·H2O)> c(OH-) C、c点溶液中: c(Ba2+)+ c(NH4+)= c(SO42-) D、d 点溶液中: c(NH3·H2O)> c(SO42-)>c(NH4+)> c(OH-)> c(H+)
A、a点溶液中: c(NH4+) +c(NH3·H2O)=0.2 mol/L B、b点溶液中: c(NH4+)>c(SO42-)>c(H+)> c(NH3·H2O)> c(OH-) C、c点溶液中: c(Ba2+)+ c(NH4+)= c(SO42-) D、d 点溶液中: c(NH3·H2O)> c(SO42-)>c(NH4+)> c(OH-)> c(H+)二、多选题
-
13. 柔红酮是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
 A、每个柔红酮分子中含有2个手性碳原子 B、柔红酮分子中所有的碳原子都在同一个平面上 C、1 mol柔红酮最多可与2 mol Br2发生取代反应 D、一定条件下柔红酮可发生氧化、加成、消去反应14. 下列说法正确的是( )A、向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大 B、电镀时,通常把待镀金属制品作阴极,镀层金属作阳极 C、常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的△H>0 D、工业通过反应“Na(l)+KCl(l) NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾15. 温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2 , 再次达平衡时H2的体积分数为20%。下列说法正确的是( )
A、每个柔红酮分子中含有2个手性碳原子 B、柔红酮分子中所有的碳原子都在同一个平面上 C、1 mol柔红酮最多可与2 mol Br2发生取代反应 D、一定条件下柔红酮可发生氧化、加成、消去反应14. 下列说法正确的是( )A、向稀醋酸溶液中加入少量醋酸钠固体,醋酸的电离程度增大 B、电镀时,通常把待镀金属制品作阴极,镀层金属作阳极 C、常温下,2NO2(g)=2NO(g)+O2(g)不能自发进行,则该反应的△H>0 D、工业通过反应“Na(l)+KCl(l) NaCl(l)+K(g)”冶炼钾,说明钠的金属性强于钾15. 温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2 , 再次达平衡时H2的体积分数为20%。下列说法正确的是( ) A、t1时刻充入H2 , v′正、v′逆变化如右图 B、第一次达平衡时,H2的体积分数小于20% C、温度为T时,起始向原容器中充入0.1 mol铁粉、0.04 mol H2O(g)、0.1 mol Fe3O4(s)、0.005 mol H2(g),反应向正反应方向进行 D、温度为T时,向恒压容器中加入足量Fe3O4(s)和0.08 mol H2 (g),达平衡时H2(g)转化率为20%
A、t1时刻充入H2 , v′正、v′逆变化如右图 B、第一次达平衡时,H2的体积分数小于20% C、温度为T时,起始向原容器中充入0.1 mol铁粉、0.04 mol H2O(g)、0.1 mol Fe3O4(s)、0.005 mol H2(g),反应向正反应方向进行 D、温度为T时,向恒压容器中加入足量Fe3O4(s)和0.08 mol H2 (g),达平衡时H2(g)转化率为20%三、综合题
-
16. 碳酸钙可用作食品添加剂。以磷石膏(主要成分为CaSO4·2H2O)为原料制备碳酸钙的一种工艺流程如下:
 (1)、已知磷石膏“水洗”前后的部分杂质质量分数变化如下表:
(1)、已知磷石膏“水洗”前后的部分杂质质量分数变化如下表:SiO2
P2O5
Al2O3
F-
Fe2O3
水洗前/%
9.21
3.08
0.55
0.68
0.19
水洗后/%
8.96
1.37
0.46
0.29
0.27
则“水洗“除去的主要杂质是。
(2)、气体A 的化学式为。(3)、“碳化”时发生反应的化学方程式为。其他条件一定时,“碳化”反应中CaSO4的转化率随温度的变化如右图所示,温度高于45℃,CaSO4的转化率下降的原因是。 (4)、工业上电解(NH4)2SO4溶液可制取过二硫酸铵[(NH4)2S2O8],其中S2O82-的结构如下。电解时阳极的电极反应式为 , 过二硫酸铵可用于游泳池中水的消毒,其原因是。
(4)、工业上电解(NH4)2SO4溶液可制取过二硫酸铵[(NH4)2S2O8],其中S2O82-的结构如下。电解时阳极的电极反应式为 , 过二硫酸铵可用于游泳池中水的消毒,其原因是。 17. 化合物E是一种合成高血压药物的中间体,其合成路线流程图如下:
17. 化合物E是一种合成高血压药物的中间体,其合成路线流程图如下: (1)、
(1)、 中所含官能团名称为和。 (2)、苯环上的硝基对新引入基团的位置会产生一定的影响,如:
中所含官能团名称为和。 (2)、苯环上的硝基对新引入基团的位置会产生一定的影响,如: (产物中,间二硝基苯占93%)苯经两步反应制得A,第一步反应的条件为。(3)、写出同时满足下列条件的B的一种同分异构体X的结构简式: 。
(产物中,间二硝基苯占93%)苯经两步反应制得A,第一步反应的条件为。(3)、写出同时满足下列条件的B的一种同分异构体X的结构简式: 。①含有两个苯环,分子中有6种不同化学环境的氢;
②既能与盐酸反应,又能与NaHCO3溶液反应。
(4)、合成E时,还可能生成一种与E互为同分异构体的副产物Y,Y的结构简式为。(5)、常温下,苯酚在Br2的CCl4溶液中发生取代反应,得到一溴代物。请写出以苯酚、CCl4为原料制备 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。 18. 硝酸铈铵、磷酸锰铵是两种重要的复盐,在工农业生产中具有广泛应用。(1)、复盐是由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐。下列物质属于复盐的是________(填序号)。A、BaFe2O4 B、NaHSO4 C、KAl(SO4)2·12H2O D、Ag (NH3)2OH(2)、硝酸铈铵[(NH4)2Ce(NO3)6]的制备方法如下:
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。 18. 硝酸铈铵、磷酸锰铵是两种重要的复盐,在工农业生产中具有广泛应用。(1)、复盐是由两种或两种以上金属离子(或铵根离子)和一种酸根离子构成的盐。下列物质属于复盐的是________(填序号)。A、BaFe2O4 B、NaHSO4 C、KAl(SO4)2·12H2O D、Ag (NH3)2OH(2)、硝酸铈铵[(NH4)2Ce(NO3)6]的制备方法如下:
①“氧化”得到CeO2的化学方程式为。
②证明CeO2已经洗涤干净的方法是。
(3)、为测定磷酸锰铵[(NH4)aMnb(PO4)c·xH2O]的组成,进行如下实验:①称取样品2.448 0 g,加水溶解后配成100.00 mL溶液A;②量取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 0.067 20 L(标准状况);③另取25.00 mL溶液A,边鼓空气边缓慢滴加氨水,控制溶液pH 6 ~ 8,充分反应后,将溶液中Mn2+转化为Mn3O4 , 得Mn3O4 0.2290 g。通过计算确定该样品的化学式(写出计算过程) 。19. 黑灰的主要成分是硫化钡(BaS),常用于制取氧化钡等钡盐。I.工业上常用如下方案测定黑灰中BaS含量:
步骤:准确称取一定质量黑灰试样置于烧杯中,加入适量的蒸馏水使黑灰充分溶解。
步骤2:过滤并洗涤残留固体2~3次,将滤液、洗涤液合并后完全转移至500mL容量瓶中,加水定容。
步骤3:取20.00mL步骤2中溶液于锥形瓶中,再迅速加入10mL2%醋酸稀溶液及25.00mL 0.5mo1/L碘标准溶液(过量),充分振荡,使BaS完全转化为S。
步骤4 向锥形瓶中加入2-3滴淀粉溶液,用0.1mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液体积VmL(I2+2S2O32-=2I-+S4O62- )。
步骤5....
步骤6 数据处理,计算黑灰中BaS含量。
(1)、步骤2实验中所需的玻璃仪器有烧杯、漏斗.500mL容量瓶、。(2)、步骤4到达滴定终点时,滴定管中液面如图所示,此时滴定管读数为 mL。若盛装Na2S2O3标准溶液的滴定管未润洗,则所测得的 BaS含量将会 (填“偏高”、“偏低"或“ 不变” )。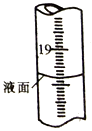 (3)、为保证实验结果的准确性,步骤5应为。(4)、II.氯化钡可用于测定煤矿酸性矿井水中硫酸盐的含量。
(3)、为保证实验结果的准确性,步骤5应为。(4)、II.氯化钡可用于测定煤矿酸性矿井水中硫酸盐的含量。酸性矿井水( 主要含有H+、Fe2+、SO42-)是煤层中夹杂的硫铁矿(FeS2)被空气中氧气氧化所致,该反应的离子方程式为。
(5)、查阅资料发现铁元素的存在对SO2含量(mg/L)的测定结果影响较大。请补充完整测定酸性矿井水中SO42-含量的实验步骤:量取一定体积的酸性矿井水, , 根据采集的数据计算废水中SO42-含量。(实验中须使用的试剂有:稀氨水、30%双氧水、1mol/L BaCl2溶液)
20. H2Y2-是乙二胺四乙酸根( )的简写,可与多种金属离子形成络合物。
)的简写,可与多种金属离子形成络合物。I. H2Y2-与Fe2+形成的络合物FeY2- 可用于吸收烟气中的NO。其吸收原理:
FeY2- (aq)+ NO(g) FeY2-(NO) (aq) △H<0
(1)、 将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如右图。时间越长,NO吸收率越低的原因是。 (2)、生成的FeY2-(NO) (aq)可通过加入铁粉还原再生,其原理:FeY2-(NO) (aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。
(2)、生成的FeY2-(NO) (aq)可通过加入铁粉还原再生,其原理:FeY2-(NO) (aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为。
(3)、II.络合铜(CuY2-)废水的处理一直是环境工程领域的研究热点。H2Y2-与Cu2+、Fe3+、Ca2+络合情况如下表:
络合反应
lgK(K 为平衡常数)
Cu2++ H2Y2- CuY2-+ 2H+
18.8
Fe3++ H2Y2- FeY-+ 2H+
25.1
Ca2++ H2Y2- CaY2-+ 2H+
10.7
①表中最不稳定的金属络合物是(填化学式)。向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A 可解离出Cu2+ , 则盐A中阳离子为(填化学式)。
②调节pH可将解离出的Cu2+转化为Cu(OH)2沉淀,若要使c(Cu2+)≤2.2×10-4mol/L,pH应不低于(常温下Ksp[Cu(OH)2]= 2.2×10-20)。
(4)、羟基自由基(-OH)、Na2FeO2都可氧化络合铜中的Y4-而使Cu2+得到解离。①酸性条件下,-OH 可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。该反应的离子方程式为。
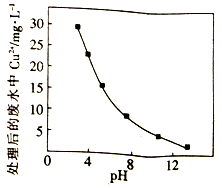
②Na2FeO4 在酸性条件下不稳定。用Na2FeO4 处理后的废水中Cu2+的浓度与pH的关系如右图。pH越大,废水处理效果越好,这是因为。
 21. 在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下:
21. 在HClO4-NaClO4介质中,K5[Co3+O4W12O36](简记为Co3+W)催化氧化NH2OH的过程如下: (1)、Co2+基态核外电子排布式为。(2)、NH2OH 分子中氮原子轨道的杂化类型是 , 1mol NH2OH 分子中含有σ键的数目为。(3)、N、H、O 三种元素的电负性由小到大的顺序为。(4)、ClO4- 的空间构型为。(5)、一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为。
(1)、Co2+基态核外电子排布式为。(2)、NH2OH 分子中氮原子轨道的杂化类型是 , 1mol NH2OH 分子中含有σ键的数目为。(3)、N、H、O 三种元素的电负性由小到大的顺序为。(4)、ClO4- 的空间构型为。(5)、一种铁、碳形成的间隙化合物的晶体结构如右图所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为。 22. 2-甲基-2-己醇常用于合成洗涤剂、乳化剂等。实验室制备2-甲基-2-己醇的流程如下:
22. 2-甲基-2-己醇常用于合成洗涤剂、乳化剂等。实验室制备2-甲基-2-己醇的流程如下:
已知:RMgBr化学性质活泼,易与H2O、R'X 等发生反应生成RH、R-R'。
(1)、仪器A的名称是。(2)、引发CH3(CH2)3Br 与镁屑反应可微热或加入米粒大小的碘单质,其中碘的作用可能是 , 若镁屑不足,则反应时生成的有机副产物为 (填结构简式)。 (3)、 干燥管中无水氯化钙的作用为。(4)、加入丙酮及稀硫酸时均需用冰水冷却,这是因为。(5)、起始加入三颈烧瓶的1-溴丁烷的体积为5 mL,密度为1.28g/mL,最终所得产品的质量为2.71g,则2-甲基-2-己醇的产率为。
(3)、 干燥管中无水氯化钙的作用为。(4)、加入丙酮及稀硫酸时均需用冰水冷却,这是因为。(5)、起始加入三颈烧瓶的1-溴丁烷的体积为5 mL,密度为1.28g/mL,最终所得产品的质量为2.71g,则2-甲基-2-己醇的产率为。