江苏省南通、徐州、扬州、泰州、淮安、宿迁六市2017-2018学年高考化学二模考试试卷
试卷更新日期:2018-05-23 类型:高考模拟
一、单选题
-
1. 习近平总书记说:把垃圾资源化,化腐朽为神奇,是一门艺术。下列有关做法合理的是( )A、回收农田秸秆用于制造纸张 B、回收废油脂用于提炼氨基酸 C、回收厨余垃圾用于提取食用油 D、回收废医用塑料用于制造餐具2. 下列有关化学用语表示正确的是( )A、氨气分子的电子式:
 B、质子数为53中子数为78的碘原子
C、对硝基苯酚的结构简式.
B、质子数为53中子数为78的碘原子
C、对硝基苯酚的结构简式.  D、NaHCO3水解的离子方程式:
D、NaHCO3水解的离子方程式:  3. 下列有关物质性质与用途具有对应关系的是( )A、H2O2具有强氧化性,可用作消毒剂 B、Fe2(SO4)3易溶于水,可用作净水剂 C、NH3具有还原性可用作制冷剂 D、C2H4具有可燃性可用作催熟剂4. 下列通过制取硫酸铝、氢氧化铝,获得氧化铝的装置和原理能达到实验目的的是( )A、
3. 下列有关物质性质与用途具有对应关系的是( )A、H2O2具有强氧化性,可用作消毒剂 B、Fe2(SO4)3易溶于水,可用作净水剂 C、NH3具有还原性可用作制冷剂 D、C2H4具有可燃性可用作催熟剂4. 下列通过制取硫酸铝、氢氧化铝,获得氧化铝的装置和原理能达到实验目的的是( )A、 制硫酸铝
B、
制硫酸铝
B、 制氢氧化铝
C、
制氢氧化铝
C、 过滤氢氧化铝
D、
过滤氢氧化铝
D、 灼烧制氧化铝
5. 下列指定反应的离子方程式正确的是( )A、用惰性电极电解CuSO4溶液2Cu2++4OH- 2Cu+O2↑+2H2O B、在Na2SiO3溶液中加入盐酸: C、在稀硝酸中加入过量的铁屑 D、在NaHCO3溶液中加入过量Ba(OH)2溶液6. 四种短周期主族元素W、X、Y、Z原子序数依次增大,它们原子最外层电子数之和为18。X的核电荷数是Z的核电荷数的一半,W的单质是空气中含量最多的气体。下列说法正确的是( )A、原子半径:r(Z)<r(X)<r(W)<r(Y) B、W的简单气态氢化物的热稳定性比X的弱 C、Y与X形成的化合物中只含有离子键 D、同周期元素中Z的最高价氧化物对应水化物的酸性最强7. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、8. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、澄清透明溶液中 B、0.1mol/L(NH4)2CO3溶液中: C、pH=l的溶液中 D、 的溶液中9. 在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O(l),示意图如下:
灼烧制氧化铝
5. 下列指定反应的离子方程式正确的是( )A、用惰性电极电解CuSO4溶液2Cu2++4OH- 2Cu+O2↑+2H2O B、在Na2SiO3溶液中加入盐酸: C、在稀硝酸中加入过量的铁屑 D、在NaHCO3溶液中加入过量Ba(OH)2溶液6. 四种短周期主族元素W、X、Y、Z原子序数依次增大,它们原子最外层电子数之和为18。X的核电荷数是Z的核电荷数的一半,W的单质是空气中含量最多的气体。下列说法正确的是( )A、原子半径:r(Z)<r(X)<r(W)<r(Y) B、W的简单气态氢化物的热稳定性比X的弱 C、Y与X形成的化合物中只含有离子键 D、同周期元素中Z的最高价氧化物对应水化物的酸性最强7. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、8. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、澄清透明溶液中 B、0.1mol/L(NH4)2CO3溶液中: C、pH=l的溶液中 D、 的溶液中9. 在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O(l),示意图如下: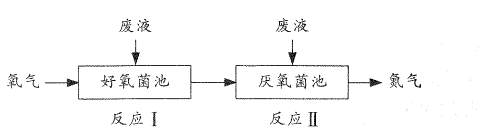
反应I
反应Ⅱ
下列说法正确的是( )
A、两池发生的反应中,氮元素只被氧化 B、两池中投放的废液体积相等时,NH4+能完全转化为N2 C、常温常压下,反应Ⅱ中生成22.4LN2转移的电子数为3.75×6 02×1023 D、10. 铝石墨双离子电池是一种全新低成本、高效电池。原理为:AlLi+Cx(PF6) Al+xC+Li++PF6-。电池结构如图所示。下列说法正确的是( )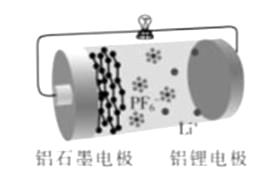 A、放电时,外电路中电子向铝锂电极移动 B、放电时,正极反应为Cx(PF6)+e-=xC+PF6- C、充电时,应将铝石墨电极与电源负极相连 D、充电时,若电路中通过1 mol电子,阴极质量增加9 g11. 某有机合成中间体的结构简式如右图所示。下列关丁该有机物的叙述正确的是( )
A、放电时,外电路中电子向铝锂电极移动 B、放电时,正极反应为Cx(PF6)+e-=xC+PF6- C、充电时,应将铝石墨电极与电源负极相连 D、充电时,若电路中通过1 mol电子,阴极质量增加9 g11. 某有机合成中间体的结构简式如右图所示。下列关丁该有机物的叙述正确的是( ) A、分子式为C9H8O4 B、在一定条件下可与HCHO发生缩聚反应 C、在浓硫酸作用下可发生消去反应 D、1 mol该物质最多能与3mol Br2发生取代反应12. 根据下列实验操作和现象所得到的结论正确的是( )
A、分子式为C9H8O4 B、在一定条件下可与HCHO发生缩聚反应 C、在浓硫酸作用下可发生消去反应 D、1 mol该物质最多能与3mol Br2发生取代反应12. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作
实验现象
实验结论
A
向过氧化钠样品中滴加过量的盐酸,将生成的气体通入CaCl2溶液
无白色沉淀产生
样品未变质
B
向氯仿(CHCl3)样品中加入AgNO3溶液
有白色沉淀产生
样品已变质
C
将漂白粉样品溶于水,加入盐酸和KI溶液,再加入CCl4振荡,静置
下层液体呈紫红色
样品未变质
D
将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液
有白色沉淀产生
样品已变质
A、A B、B C、C D、D二、多选题
-
13. 下列有关说法正确的是( )A、镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 B、等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同 C、0.1 mol·L-1NH4Cl溶液加水稀释, 的值减小 D、对于反应2SO2+O2 2SO3 , 使用催化剂能加快反应速率和提高SO2的平衡转化率14. 常温下下列溶液中确关微粒的物质的量浓度关系正确的是( )A、等物质的量浓度的CuSO4和(NH4)2SO4的混合溶液 B、0.2 mol/L NaHCO3溶液和0.1 mol/LNaOH溶液等体积相混合: C、pH=2的盐酸与pH=12的氨水等体积混合 D、0.1 mol/LCH3COONa溶液中通入HCl气体,至pH=7(溶液体积变化忽略不计):15. Boderlscens研究反应:H2(g)+I2(g) 2HI(g) △H<0.温度T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数ω(HI)与反应时间t的关系如下表:

研究发现上述反应中 其中 为常数。下列说法正确的是( )
A、温度为T时该反应的 B、容器I中前20 min的平均速率v(HI)=0.0125mol.L-1.min-1 C、若起始时,向容器I中加入物质的量均为0.1 mol的H2、I2、HI,反应逆向进行 D、若两容器中 且 则x的值一定为1三、综合题
-
16. CoCO3是一种制造锂电池电极的原料。以含钴废渣(主要成分CoO、Co2O3 , 还含有Al2O3、ZnO等杂质)为原料制备CoCO3的一种工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol/L计算)
 (1)、“酸浸”时通入SO2的目的是。(2)、“除铝”时调节溶液pH范围为 , 该过程中主要反应的离子方程式为。(3)、“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是(4)、“沉钴”时Na2CO3溶液需缓慢滴加的原因是 。(5)、CoCO3隔绝空气灼烧可以生成Co2O3 , 该反应的化学方程式为 。17. 白花丹酸具有镇咳祛痰的作用,其合成路线流程图如下:
(1)、“酸浸”时通入SO2的目的是。(2)、“除铝”时调节溶液pH范围为 , 该过程中主要反应的离子方程式为。(3)、“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是(4)、“沉钴”时Na2CO3溶液需缓慢滴加的原因是 。(5)、CoCO3隔绝空气灼烧可以生成Co2O3 , 该反应的化学方程式为 。17. 白花丹酸具有镇咳祛痰的作用,其合成路线流程图如下: (1)、A中的含氧官能团名称为和。(2)、C-D的反应类型为 。(3)、白花丹酸分子中混有
(1)、A中的含氧官能团名称为和。(2)、C-D的反应类型为 。(3)、白花丹酸分子中混有 ,写出同时满足下列条件的该有机物的一种同分异构体的结构简式:。
,写出同时满足下列条件的该有机物的一种同分异构体的结构简式:。①分子中有四种不同化学环境的氢;②与FeCl3溶液能发生显色反应,且1 mol该物质最多能与3 mol NaOH反应.
(4)、E的结构简式为 。(5)、已知: 根据已有知识并结合相关信息写出以
根据已有知识并结合相关信息写出以  和CH3CH2OH为原料制备
和CH3CH2OH为原料制备  的合成路线流程图(合成路线流程图示例见本题题干)。 18. 过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:
的合成路线流程图(合成路线流程图示例见本题题干)。 18. 过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:
反应原理 该反应放热.
(1)、选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如右图所示。5%的H2O2比20%的H2O2利用率低的原因是。 (2)、SrO2.2H2O遇CO2会反应变质,反应的化学方程式为。(3)、25℃时,将Sr(NO3)2溶液滴加到含有F-、CO32-的溶液中,当混合溶液中c(Sr2+)= 0.0010 mol/L时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=。
(2)、SrO2.2H2O遇CO2会反应变质,反应的化学方程式为。(3)、25℃时,将Sr(NO3)2溶液滴加到含有F-、CO32-的溶液中,当混合溶液中c(Sr2+)= 0.0010 mol/L时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=。
(4)、准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2 , 再加入足量KI摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 moI/L Na2S2O3标准溶液滴定到蓝色恰好消失时,共消耗标准溶液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程。(已知:Ksp(SrF2)=4.0×10-9 , Ksp(SrCO3)=5.0×10-9)19. FePO4是一种难溶于水、易溶于硫酸的固体,可用作金属防腐剂。实验室利用FeSO4.7H2O和H3PO4。(第一级电离常数Ka1=7.5×10-3)制备FePO4流程如下: (1)、“溶解”时H3PO4不宜过量太多的原因是。(2)、①写出“反应”时总反应的离子方程式:。
(1)、“溶解”时H3PO4不宜过量太多的原因是。(2)、①写出“反应”时总反应的离子方程式:。②证明“反应”后铁元素沉淀完全的实验方法是。
(3)、①“过滤”所得产品呈棕黄色,则FePO4可能混有的杂质是。②洗涤FePO4沉淀的操作是 。
(4)、FeSO4与(NH4)2SO4反应可制得摩尔盐[(NH4)2Fe (SO4)2.6H2O]。摩尔盐易溶于水.不溶于乙醇,性质比一般亚铁盐稳定,接近100℃时易失去结晶水。相关物质的溶解度曲线如图所示。
请补充完整由久置于空气中的FeSO4.7H2O样品合成摩尔盐的.实验步骤:将样品溶于适量的硫酸溶液中,加热使其溶解,然后向其中加入。可选试剂:蒸馏水、饱和硫酸铵溶液、 3% H2O2、铜粉、铁粉、无水乙醇。
20. 采用新技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建设。(1)、采用“联合脱硫脱氮技术” 处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2的副产品,工业流程如图所示。
①反应釜I采用“气—液逆流”接触吸收法(如图),其优点是。

②反应釜II中CaSO3转化为CaSO4的化学反应方程式为。
(2)、为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2 , 改变加入CO的物质的量,反应后体系中产物随CO的变化如图所示。其中产物Y的化学式是。 (3)、O2/CO2燃烧技术是指化石燃料在O2和CO2的混合气体中燃烧而不是在空气中燃烧,通过该燃烧技术可收集到高纯度的CO2。
(3)、O2/CO2燃烧技术是指化石燃料在O2和CO2的混合气体中燃烧而不是在空气中燃烧,通过该燃烧技术可收集到高纯度的CO2。①与在空气中燃烧相比,利用O2/CO2燃烧技术,烟气中NOx的排放量明显降低,其主要原因是。
②利用太阳能可实现反应:2CO2(g)=2CO(g)+O2(g),该反应能自发进行的原因是。
③700℃时,以Ni-MgO/γ-Al2O3作催化剂,向2 L密闭容器中通入CO2和CH4各3 mol,发生反应:CO2(g)+CH4(g)
 2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为。
2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为。④CO2在新型钴基电催化剂作用下可转化为清洁燃料—甲酸。其工作原理如图所示,写出生成甲酸的电极反应式:。
 21. 镍、铂、镧等过渡金属单质及化合物在医疗领域有着广泛的应用。(1)、基态原子镍的价电子排布式为。(2)、抗癌药奥沙利铂(又名乙二酸铂)的结构简式如图所示。
21. 镍、铂、镧等过渡金属单质及化合物在医疗领域有着广泛的应用。(1)、基态原子镍的价电子排布式为。(2)、抗癌药奥沙利铂(又名乙二酸铂)的结构简式如图所示。
①分子中氮原子轨道的杂化类型是 , C、N、O三种元素的第一电离能由大到小的顺序为。
②1 mol乙二酸分子中含有σ键的数目为。
(3)、碳酸镧[La2(CO3)3]可用于治疗高磷血症。写出与CO32-互为等电子体的一种分子的化学式: 。(4)、镧镰合金可用于储氢,储氢之后所得晶体的化学式为LaNi5(H2)3 , 其晶体的最小重复结构单元如图所示(◎、O、●代表储氢之后晶体中的三种微粒)。图中●代表的微粒是。 22. 维生素C又名抗坏血酸,结构简式为
22. 维生素C又名抗坏血酸,结构简式为 .维生素C在碱性溶液中易被氧化,能被I2定量氧化
.维生素C在碱性溶液中易被氧化,能被I2定量氧化  测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):步骤一:将1.3 g I2溶于少量KI浓溶液,转入1000 mL容量瓶中,加入蒸馏水定容后置于棕色瓶避光保存,备用。
步骤二:称取100 g去皮、去核的新鲜橙子和40 mL草酸溶液混合榨汁,后将果汁全部移入锥形瓶,加入适量的活性炭,抽滤,将所得果汁稀释至100 mL密封保存。
步骤三:准确移取10.00 mL果汁,加入20 mL l%草酸溶液和1mL l%淀粉溶液,用标准碘溶液进行滴定至终点,记录消耗的标准碘溶液的体积。
步骤四:重复步骤三2~3次。
步骤五:数据处理,计算100g橙子中维生素C的含量。
(1)、步骤一中配制标准碘溶液时,将I2加入到KI浓溶液的目的是 , 所需要的玻璃仪器有烧杯、1000 mL容量瓶、;(2)、步骤二中加入活性炭的作用是;抽滤使用的主要仪器是;(3)、在步骤二和步骤三中均加入草酸溶液的目的是;(4)、步骤二和步骤三通常需控制在2分钟内完成,若超时会导致测定结果 填“偏大”、“偏小”或“无影响”)。