北京市大兴区2017-2018学年高考理综-化学一模考试试卷
试卷更新日期:2018-05-23 类型:高考模拟
一、单选题
-
1. 2018年,平昌冬奥会上“北京8分钟”以充满中国智慧和中国科技的表演惊艳世界,下列有关说法中错误的是( )
 A、熊猫木偶的材质采用铝合金和碳纤维,可以减轻重量 B、演出服中的石墨烯是一种新型的纳米材料 C、低温环境会影响机器人的电池性能 D、机器人芯片的主要成分为SiO22. 下列有关性质的比较,不能用元素周期律解释的是( )A、原子半径:C > O B、酸性:HCl > H2SiO3 C、热稳定性:H2O > H2S D、金属性:Na > Al3. FeCl3溶液与下列物质反应,对现象的解释错误的是( )
A、熊猫木偶的材质采用铝合金和碳纤维,可以减轻重量 B、演出服中的石墨烯是一种新型的纳米材料 C、低温环境会影响机器人的电池性能 D、机器人芯片的主要成分为SiO22. 下列有关性质的比较,不能用元素周期律解释的是( )A、原子半径:C > O B、酸性:HCl > H2SiO3 C、热稳定性:H2O > H2S D、金属性:Na > Al3. FeCl3溶液与下列物质反应,对现象的解释错误的是( )物质
现象
解释
A
SO2
溶液变为浅绿色
2Fe3+ + SO2 + 2H2O= 2Fe2+ + SO42- + 4H+
B
氨水
有红褐色沉淀产生
Fe3+ + 3OH- = Fe(OH)3↓
C
NaHCO3溶液
有红褐色沉淀产生,并伴有无色气泡
Fe3+ + 3HCO3- = Fe(OH)3↓ + 3CO2↑
D
Mg(OH)2浊液
有红褐色沉淀产生
3Mg(OH)2(s)+ 2Fe3+(aq)= 2Fe(OH)3(s)+3Mg2+(aq)
A、A B、B C、C D、D4. 厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中错误的是( )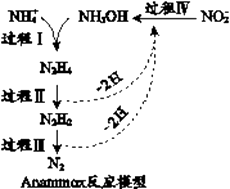 A、1mol NH4+ 所含的质子总数为10NA B、联氨(N2H4)中含有极性键和非极性键 C、过程II属于氧化反应,过程IV属于还原反应 D、过程I中,参与反应的NH4+与NH2OH的物质的量之比为1:15. 高聚物(L)是一种来源于生物学灵感的新型粘合剂,其原料取材于植物和贻贝。下列关于高聚物(L)的说法中错误的是( )
A、1mol NH4+ 所含的质子总数为10NA B、联氨(N2H4)中含有极性键和非极性键 C、过程II属于氧化反应,过程IV属于还原反应 D、过程I中,参与反应的NH4+与NH2OH的物质的量之比为1:15. 高聚物(L)是一种来源于生物学灵感的新型粘合剂,其原料取材于植物和贻贝。下列关于高聚物(L)的说法中错误的是( ) A、单体之一为
A、单体之一为 B、在一定条件下能发生水解反应
C、生成1mol L的同时,会有(x+y-1)mol H2O生成
D、1mol L最多可与3mol H2发生加成反应
6. 利用如图所示装置进行下列实验,现象和结论均正确的是( )
B、在一定条件下能发生水解反应
C、生成1mol L的同时,会有(x+y-1)mol H2O生成
D、1mol L最多可与3mol H2发生加成反应
6. 利用如图所示装置进行下列实验,现象和结论均正确的是( )选项
①
②
③中现象
结论
装置图
A
浓硝酸
Cu
淀粉-KI溶液变蓝
NO2为氧化性气体

B
稀硫酸
Na2SO3
品红溶液褪色
Na2SO3未变质
C
浓盐酸
MnO2
FeBr2溶液变为黄色
氧化性:Cl2>Br2
D
浓氨水
NaOH
湿润红色石蕊试纸变蓝
NH3为碱性气体
A、A B、B C、C D、D7. 已知: 2NO2(g)+ CH4(g) N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比= ] ;下列说法错误的是( ) A、ΔH < 0 B、X > 2 C、400K时,反应的平衡常数为5×10-2 D、投料比为2时,Q点v逆(CH4)小于P点的v逆(CH4)
A、ΔH < 0 B、X > 2 C、400K时,反应的平衡常数为5×10-2 D、投料比为2时,Q点v逆(CH4)小于P点的v逆(CH4)二、综合题
-
8. 匹多莫德是一种免疫调节剂,其合成路线如下:

已知:i

ii
 (1)、A中官能团名称。(2)、B的结构简式。(3)、②的反应类型。(4)、写出谷氨酸生成F的化学方程式。
(1)、A中官能团名称。(2)、B的结构简式。(3)、②的反应类型。(4)、写出谷氨酸生成F的化学方程式。该过程,还可能生成高聚物,写出任意一种的结构简式。
(5)、③的化学方程式。(6)、写出半胱氨酸与HCHO反应生成G的化学方程式。(7)、结合信息,写出以乙醇和必要无机试剂合成 的路线。 9. CO2的绿色减排、捕捉、转化是人类可持续发展的重要战略之一。(1)、CO2来源之一是汽车尾气
的路线。 9. CO2的绿色减排、捕捉、转化是人类可持续发展的重要战略之一。(1)、CO2来源之一是汽车尾气

①根据上图,写出气缸内产生NO的热化学方程式。
②写出转换器中在催化剂作用下NOx和CO反应的化学方程式。

③在催化转换器中机动车尾气转化效率与空燃比(空气与燃油气的体积比)的关系如右图。若空燃比小于14.7,氧气不足,CxHy和CO不能被完全氧化,导致其转化效率降低;若空燃比大于14.7,则NOx的转化效率降低,原因是。
(2)、利用NaOH溶液可以“捕捉” CO2|氧气过量,还原性气体CO和Cx Hy首先和O2反应,使得NOx的还原反应很难继续进行已知:0.448L CO2(已折算标准状况)被NaOH溶液充分吸收,得到100mL含有Na2CO3和NaHCO3的吸收液。
①向吸收液中加入足量BaCl2溶液得到沉淀,经过滤、洗涤、干燥后,称重为1.97g,则吸收液中c(Na2CO3) = 。(该条件下NaHCO3与BaCl2不反应)
②对该吸收液,下列判断正确的是。
a . c (CO32- ) > c (HCO3- )
b. 2c (CO32- ) + c (HCO3- ) + c (OH- ) = c (H+ ) + c (Na+ )
c. c (H2CO3) + c (HCO3- ) + c (CO32- ) =0.2mol•L-1
(3)、工业上可用CO2来制甲醇①CO2 (g) + 3H2(g) CH3OH(g) + H2O(g) ΔH < 0
根据图1分析,实际工业生产中,反应温度选择250℃的理由。
②利用光电催化原理,由CO2和H2O制备CH3OH的装置如图2。写出右侧的电极反应式。
 10. 金属钇(Y)具有重要的国防价值,但因过度开采已濒临枯竭。通过硫酸浸泡深海磷灰石矿,可以得到Y3+的浸出液:
10. 金属钇(Y)具有重要的国防价值,但因过度开采已濒临枯竭。通过硫酸浸泡深海磷灰石矿,可以得到Y3+的浸出液:表1 浸出液成分
Al3+
Fe3+
Ca2+
PO43-
Mg2+
Mn2+
Y3+
浓度/(mg•L-1)
7670
9460
550
640
5600
1500
70.2
(1)、浸出液可用有机溶剂(HR)进行萃取,实现Y3+的富集(已知:Y3+与Fe3+性质相似),原理如下:Fe3+ + 3HR FeR3 + 3H+ Y3+ + 3HR YR3 + 3H+ (已知:FeR3、YR3均易溶于HR)浸出液在不同pH下萃取的结果如图1。

①用化学平衡原理解释,随pH增大,Y3+萃取率增大的原因。
②结合图1解释,工业上萃取Y3+之前,应首先除去Fe3+的原因是。
(2)、采用“中和沉淀法”和“磷酸法”可以除铁。表2 Fe3+、Y3+去除率
终点pH
去除率/%
Fe3+
Y3+
3.0
87.84
19.86
3.5
92.33
23.63
4.5
99.99
44.52
5.0
99.99
89.04
中和沉淀法:向浸出液中加入NaOH除Fe3+ , 去除率如表2所示。
①该实验条件下,Fe3+去除率比Y3+大的可能原因。
磷酸法:将磷酸(H3PO4:三元弱酸)加入到浸出液中,再加入Na2CO3溶液,调pH为2.5,过滤除去磷酸铁沉淀(FePO4),滤液中剩余的Fe3+、Y3+浓度如表3。
表3 滤液中Fe3+、Y3+的浓度
Fe3+
Y3+
浓度/(mg•L-1)
508
68.9
② 配平“磷酸法”除铁过程中的离子方程式
Fe3+ + + = FePO4↓+ CO2↑+
③ 综合分析表1、表2、表3,工业上采用“磷酸法”除铁的原因。
(3)、经“磷酸法”除铁后,用有机溶剂HR萃取Y3+ , 可通过(填操作)收集含Y3+的有机溶液。(4)、综合分析以上材料,下列说法合理的是。a. 分析图1可知,pH在0.2~2.0范围内,有机溶剂中的Fe3+多于水溶液中的Fe3+
b. 表2中 Y3+损失率在20%左右的原因可能是生成的Fe(OH)3对Y3+的吸附
c. 表2中 pH在4.5~5.0范围内,Y3+损失率变大的可能原因:Y3+ + 3OH- = Y(OH)3↓
d. 有机溶剂萃取Y3+的优点是Ca2+、Mg2+、Mn2+等金属离子萃取率极低
三、实验题
-
11. 某研究小组探究电解FeCl2溶液的电极反应产物
 (1)、配制1mol•L-1FeCl2溶液,测得pH=4.91,原因(用离子方程式表示)。从化合价角度分析, Fe2+具有。(2)、该小组同学预测电解FeCl2溶液两极的现象:阳极有黄绿色气体产生,阴极有无色气体产生。
(1)、配制1mol•L-1FeCl2溶液,测得pH=4.91,原因(用离子方程式表示)。从化合价角度分析, Fe2+具有。(2)、该小组同学预测电解FeCl2溶液两极的现象:阳极有黄绿色气体产生,阴极有无色气体产生。该小组同学用右图装置电解1mol•L-1FeCl2溶液:
①取少量银灰色固体洗涤后,加稀H2SO4有气泡产生,再向溶液中加入(试剂和现象),证明该固体为Fe。
②该小组同学进一步分析红褐色固体产生的原因,甲同学认为;乙同学认为2Cl- - 2e- = Cl2↑,Cl2可氧化Fe2+最终生成Fe(OH)3 。
为证实结论,设计方案如下:用实验Ⅰ的装置和1.5v 电压,电解酸化(pH=4.91)的 , 通电5分钟后,阳极无明显现象,证实乙同学的推论错误。丙同学认为仍不严谨,原因是产生的气体溶于水,继续实验(操作和现象),进一步证实了乙同学的推论错误。
(3)、该小组同学进一步探究电解1mol•L-1FeCl2溶液电极产物的影响因素。实验
条件
操作及现象
电压
pH
阳极
阴极
Ⅰ
1.5v
4.91
无气泡产生,溶液逐渐变浑浊,5分钟后电极表面析出红褐色固体
无气泡产生,4分钟后电极表面有银灰色金属状固体附着
Ⅱ
1.5v
2.38
无气泡产生,溶液出现少量浑浊,滴加KSCN溶液变红色
无气泡产生,电极表面有银灰色金属状固体附着
Ⅲ
1.5v
1.00
无气泡产生,溶液无浑浊现象,滴加KSCN溶液变红色
有气泡产生,无固体附着
Ⅳ
3.0v
4.91
无气泡产生,溶液逐渐变浑浊,3分钟后电极表面有红褐色固体产生
极少量气泡产生,1分钟出现镀层金属
Ⅴ
6.0v
4.91
有气泡产生,遇湿润的淀粉碘化钾试纸变蓝。溶液逐渐变浑浊
大量气泡产生,迅速出现镀层金属
①对比实验Ⅰ、Ⅱ、Ⅲ可以得出结论:
阳极Fe2+放电时,酸性较强主要生成Fe3+; 酸性较弱主要生成Fe(OH)3 。阴极。
②对比实验Ⅰ、Ⅳ、Ⅴ可以得出结论:
增大电压,不仅可以改变离子的放电能力,也可以。
(4)、综合分析上述实验,电解过程中电极反应的产物与有关 。