北京市朝阳区2017-2018学年高考理综-化学二模考试试卷
试卷更新日期:2018-05-23 类型:高考模拟
一、单选题
-
1. 我国科技创新成果斐然,下列成果中以制备非金属单质为主要目的的是( )
A
B
C
D




低温制备
H2
成功开采可燃冰
(CH4·nH2O)
研制出
超高强钢
合成全氮阴离子盐
(N5)6(H3O)3(NH4)4Cl
A、A B、B C、C D、D2. 下列关于NH4Cl的化学用语正确的是( )
A、氯离子的结构示意图: B、其溶液呈酸性的原因:NH4Cl + H2O ⇌ NH3·H2O +HCl
C、工业上“氮的固定”:NH3 + HCl = NH4Cl
D、比较微粒半径:N>Cl->H
3. 下列变化中,未涉及到电子转移的是( )A、H2C2O4使酸性KMnO4溶液褪色 B、C2H5OH使酸性K2Cr2O7溶液变绿 C、CO2使苯酚钠溶液变浑浊 D、H2O2使酸化的KI溶液变黄4. 中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:
B、其溶液呈酸性的原因:NH4Cl + H2O ⇌ NH3·H2O +HCl
C、工业上“氮的固定”:NH3 + HCl = NH4Cl
D、比较微粒半径:N>Cl->H
3. 下列变化中,未涉及到电子转移的是( )A、H2C2O4使酸性KMnO4溶液褪色 B、C2H5OH使酸性K2Cr2O7溶液变绿 C、CO2使苯酚钠溶液变浑浊 D、H2O2使酸化的KI溶液变黄4. 中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:
下列说法正确的是( )
A、过程Ⅰ、过程Ⅲ均为放热过程 B、过程Ⅲ生成了具有极性共价键的H2、CO2 C、使用催化剂降低了水煤气变换反应的ΔH D、图示过程中的H2O均参与了反应过程5. 一种长效、缓释阿司匹林(有机物L)的结构如下图所示:
下列分析错误的是( )
A、有机物L为高分子化合物 B、1 mol 有机物L中含有2 mol酯基 C、有机物L能发生加成、取代、氧化反应 D、有机物L在体内可缓慢水解,逐渐释放出 6. 实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
6. 实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下: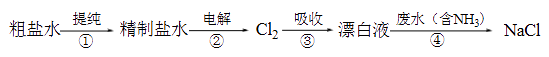
下列分析正确的是( )
A、①中采用蒸馏的方法精制粗盐水 B、②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑ C、③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO D、②、③、④中均发生了氧化还原反应7. 某小组比较Cl-、Br-、I-的还原性,实验如下:实验1
实验2
实验3
装置



现象
试管内颜色无明显变化;用蘸浓氨水的玻璃棒靠近管口,产生白烟
溶液变黄;把湿润的KI淀粉试纸靠近试管口,变蓝
溶液变深紫色;经检验溶液含单质碘
下列对实验的分析不合理的是( )
A、实验1中,白烟是NH4Cl B、根据实验1和实验2判断还原性:Br->Cl- C、根据实验3判断还原性:I->Br- D、.上述实验利用了浓H2SO4的强氧化性、难挥发性等性质二、推断题
-
8. 药物Q适用于治疗高血压、心绞痛,可由有机物P和L制备。
 (1)、有机物P的合成路线如下。
(1)、有机物P的合成路线如下。
已知:
 (R、R’、R”代表烃基或氢)
(R、R’、R”代表烃基或氢)① A的分子式为C3H8O,其所含的官能团是。
② B的核磁共振氢谱只有一个吸收峰,其结构简式是。
③ 由D生成有机物P的反应类型是。
(2)、有机物L的合成路线如下。
已知:

① 生成E的化学方程式是。
②
 与有机物M发生加成反应, M的结构简式为。
与有机物M发生加成反应, M的结构简式为。③ F含羧基,化合物N是。
④ 生成有机物L的化学方程式是。
(3)、以 为起始原料合成聚合物甲的路线如下:
为起始原料合成聚合物甲的路线如下:
写出聚合物甲的结构简式:。
三、综合题
-
9. 2017年采用中国自主知识产权的全球首套煤基乙醇工业化项目投产成功。某地煤制乙醇的过程表示如下。
 (1)、Cu(NO3)2是制备“催化剂X”的重要试剂。
(1)、Cu(NO3)2是制备“催化剂X”的重要试剂。
① 气体A是。
② 实验室用Cu(NO3)2固体配制溶液,常加入少量稀HNO3。运用化学平衡原理简述HNO3的作用。
③ NaClO溶液吸收气体A的离子方程式是。
(2)、过程a包括以下3个主要反应:Ⅰ.CH3COOCH3(g)+2H2(g) C2H5OH(g)+CH3OH(g) ΔH1
Ⅱ.CH3COOCH3(g)+C2H5OH(g) CH3COOC2H5 (g)+CH3OH(g) ΔH2
Ⅲ.CH3COOCH3(g)+H2(g) CH3CHO(g)+CH3OH(g) ΔH3
相同时间内,测得CH3COOCH3转化率、乙醇和乙酸乙酯的选择性(如乙醇选择性= )如下图所示。


① 已知:ΔH1 < 0。随温度降低,反应Ⅰ化学平衡常数的变化趋势是。
② 下列说法不合理的是。
A.温度可影响反应的选择性
B.225℃~235℃,反应Ⅰ处于平衡状态
C.增大H2的浓度,可以提高CH3COOCH3的转化率
③ 为防止“反应Ⅲ”发生,反应温度应控制的范围是。
④ 在185℃下,CH3COOCH3起始物质的量为5 mol,生成乙醇的物质的量是。
10. SO2广泛用于医药、硫酸工业等领域,回收废气中的SO2可用如下方法。方法Ⅰ
用碱式硫酸铝Al2(SO4)x(OH)y溶液吸收富集SO2
方法Ⅱ
在Fe2+或Fe3+催化下,用空气(O2)将SO2氧化为H2SO4
(1)、方法Ⅰ的过程如下。① 制备Al2(SO4)x(OH)y
向Al2(SO4)3溶液中加入CaO粉末,调pH至3.6。 CaO的作用之一是促进水解(填离子符号,下同),二是沉淀一部分。
② 吸收:Al2(SO4)x(OH)y吸收SO2后的产物是(写化学式)。
③ 解吸:加热②中产物,产生SO2 , Al2(SO4)x(OH)y再生。
(2)、方法Ⅱ中,在Fe2+催化下,SO2、O2和H2O生成H2SO4的化学方程式是。(3)、方法Ⅱ中,Fe2+的催化过程可表示如下:ⅰ:2 Fe2++ SO2+ O2=2 Fe3++ SO42-
ⅱ: ……
① 写出ⅱ的离子方程式:。
② 下列实验方案可证实上述催化过程。将实验方案补充完整。
a.向FeCl2溶液滴入KSCN,无变化
b.向FeCl2溶液通入少量SO2 , 滴入KSCN,颜色变红。
c.取b中溶液,。
(4)、方法Ⅱ中,催化氧化后,采用滴定法测定废气中残留SO2的含量。将V L(已换算为标准状况)废气中的SO2用1%的H2O2完全吸收,吸收液用下图所示装置滴定,共消耗a mL c mol/L NaOH标准液。
① H2O2氧化SO2的化学方程式。
② 废气中残留SO2的体积分数为。
四、实验题
-
11. 某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)、方案1:通过置换反应比较向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是 , 说明氧化性Ag+>Cu2+。
(2)、方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较实验
试剂
编号及现象
试管
滴管

1.0 mol/L
KI溶液
1.0 mol/L
AgNO3溶液
Ⅰ.产生黄色沉淀,溶液无色
1.0 mol/L
CuSO4溶液
Ⅱ.产生白色沉淀A,溶液变黄
① 经检验,Ⅰ中溶液不含I2 , 黄色沉淀是。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有(填离子符号)。
b.白色沉淀B是。
c.白色沉淀A与AgNO3溶液反应的离子方程式是 , 说明氧化性Ag+>Cu2+。
(3)、分析方案2中Ag+ 未能氧化I- , 但Cu2+氧化了I-的原因,设计实验如下:编号
实验1
实验2
实验3
实验



现象
无明显变化
a中溶液较快变棕黄色,b中电极
上析出银;电流计指针偏转
c中溶液较慢变浅黄色;
电流计指针偏转
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是(用电极反应式表示)。
②“实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是。
③ 方案2中,Cu2+能氧化I- , 而Ag+未能氧化I-的原因:。
(资料:Ag+ + I- = AgI↓ K1=1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2= 8.7×108)
-