2018年广东省深圳市中考化学冲刺试卷(三)
试卷更新日期:2018-05-23 类型:中考模拟
一、选择题
-
1. 以下是我省广受消费者欢迎的食品,其中主要富含糖类的是( )A、
 静宁烧鸡
B、
静宁烧鸡
B、 刘家峡草莓
C、
刘家峡草莓
C、 陇宝牌当归醋
D、
陇宝牌当归醋
D、 永登丁娃烧饼
2. 下列有关物质构成的说法不正确的是( )A、物质可由分子、原子或离子构成 B、结构示意图为
永登丁娃烧饼
2. 下列有关物质构成的说法不正确的是( )A、物质可由分子、原子或离子构成 B、结构示意图为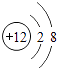 、
、 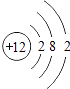 的粒子,表示了同种元素不同的粒子
C、相对原子质量为m的原子M,核外有n个电子,则核内中子数为:m﹣n
D、原子序数为16的原子,位于周期表中第2周期第ⅥA族
3. 某班同学在实验室制取二氧化碳,老师观察到了四个同学的如下操作,其中正确的是( )A、
的粒子,表示了同种元素不同的粒子
C、相对原子质量为m的原子M,核外有n个电子,则核内中子数为:m﹣n
D、原子序数为16的原子,位于周期表中第2周期第ⅥA族
3. 某班同学在实验室制取二氧化碳,老师观察到了四个同学的如下操作,其中正确的是( )A、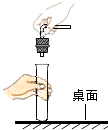 连接仪器
B、
连接仪器
B、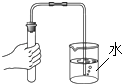 检查气密性
C、
检查气密性
C、 取用石灰石
D、
取用石灰石
D、 验满
4. 世界卫生组织认可的抗甲型H1N1流感病毒的药物,主要原料为莽草酸(化学式为C7H10O5 , 其结构如图,碳原子和部分氢原子未标出).下列关于莽草酸的叙述中不正确的是( )
验满
4. 世界卫生组织认可的抗甲型H1N1流感病毒的药物,主要原料为莽草酸(化学式为C7H10O5 , 其结构如图,碳原子和部分氢原子未标出).下列关于莽草酸的叙述中不正确的是( )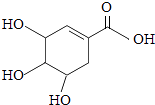 A、莽草酸中含有碳、氢、氧三类原子 B、每个莽草酸分子中含有22个原子核 C、莽草酸分子碳、氢、氧元素质量比42:5:40 D、莽草酸是由碳、氢、氧三种元素组成的化合物5. 向AgNO3溶液中加入一定质量的Zn和Cu的混合粉末,充分反应后过滤,得到滤渣和蓝色滤液,下列说法正确的是( )A、向滤渣中加入稀盐酸,可能有气泡产生 B、向滤液中加入稀盐酸,可能有沉淀产生 C、滤渣中一定有Ag,一定无Zn和Cu D、滤液中一定有Cu(NO3)2 , 可能有Zn(NO3)2和AgNO36.
A、莽草酸中含有碳、氢、氧三类原子 B、每个莽草酸分子中含有22个原子核 C、莽草酸分子碳、氢、氧元素质量比42:5:40 D、莽草酸是由碳、氢、氧三种元素组成的化合物5. 向AgNO3溶液中加入一定质量的Zn和Cu的混合粉末,充分反应后过滤,得到滤渣和蓝色滤液,下列说法正确的是( )A、向滤渣中加入稀盐酸,可能有气泡产生 B、向滤液中加入稀盐酸,可能有沉淀产生 C、滤渣中一定有Ag,一定无Zn和Cu D、滤液中一定有Cu(NO3)2 , 可能有Zn(NO3)2和AgNO36.甲、乙两种固体物质的溶解度曲线如图所示.现将两支分别装有甲、乙两种物质的饱和溶液(底部均有未溶解的固体)的试管浸入盛有水的烧杯中(如图),然后向烧杯中加入一定量的浓硫酸.则对相关变化判断正确的是( )
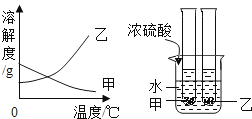 A、甲溶液中溶质的质量分数减小 B、乙溶液中溶质的质量分数减小 C、甲、乙两种物质的溶解度都增大 D、乙溶液中未溶解的固体质量增多7. 氯化钡是一种可溶性重金属盐,广泛应用于化工领域;用毒重石(主要成分为BaCO3 , 其余成分不溶于水也不与酸反应)制备氯化钡晶体工艺流程如下.下列说法正确的是( )
A、甲溶液中溶质的质量分数减小 B、乙溶液中溶质的质量分数减小 C、甲、乙两种物质的溶解度都增大 D、乙溶液中未溶解的固体质量增多7. 氯化钡是一种可溶性重金属盐,广泛应用于化工领域;用毒重石(主要成分为BaCO3 , 其余成分不溶于水也不与酸反应)制备氯化钡晶体工艺流程如下.下列说法正确的是( )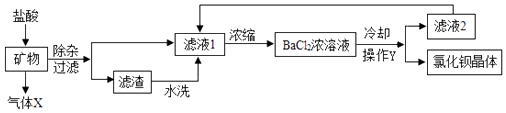 A、气体X为CO B、操作Y中需要的仪器有:烧杯、漏斗、玻璃棒、酒精灯 C、洗涤氯化钡晶体的最好洗涤剂是水 D、用水洗滤渣的目的是提高原料的利用率,减少对环境的污染8. 为了达到相应的实验目的,下列实验设计不合理的是( )A、
A、气体X为CO B、操作Y中需要的仪器有:烧杯、漏斗、玻璃棒、酒精灯 C、洗涤氯化钡晶体的最好洗涤剂是水 D、用水洗滤渣的目的是提高原料的利用率,减少对环境的污染8. 为了达到相应的实验目的,下列实验设计不合理的是( )A、 分离H2O2和MnO2制O2后的固液混合物
B、
分离H2O2和MnO2制O2后的固液混合物
B、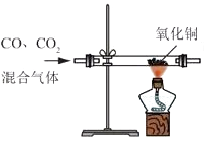 除去CO中的CO2气体
C、
除去CO中的CO2气体
C、 区分NaCl、NH4NO3、NaOH三种固体
D、
区分NaCl、NH4NO3、NaOH三种固体
D、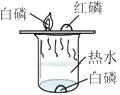 探究可燃物燃烧的条件
9. 下列实验方案设计不合理的是( )
探究可燃物燃烧的条件
9. 下列实验方案设计不合理的是( )选项
实验内容
操作或所用试剂
A
鉴别铁粉和木炭粉
观察颜色
B
鉴别氯化铵和氯化钾
加熟石灰,混合研磨
C
除去铜中混有的氧化铜
加过量稀硫酸,过滤
D
除去氧化钙中混有的碳酸钙
高温煅烧
A、A B、B C、C D、D10. 图1所示装置可用于测定空气中氧气的含量,其中与集气瓶相连的压强传感器等电子设备能将集气瓶内气体压强精确地记录并保存下来.图2、图3是用该装置测得的红磷和木炭分别在集气瓶中燃烧的压强﹣时间关系图(该装置气密性良好,p0是集气瓶内初始气压,p和p′分别是反应结束后恢复到室温时集气瓶内的气压).下列说法正确的是( )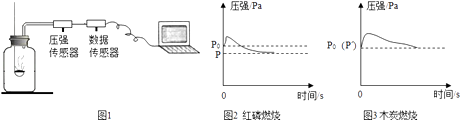 A、燃烧匙内所装红磷或木炭的多少对实验结果无影响 B、反应开始时集气瓶中压强瞬间变大的是由燃烧放热造成的 C、p=0.79p0 , p′=p0是因为红磷的着火点比木炭低 D、由图3可推出空气中氧气的含量
A、燃烧匙内所装红磷或木炭的多少对实验结果无影响 B、反应开始时集气瓶中压强瞬间变大的是由燃烧放热造成的 C、p=0.79p0 , p′=p0是因为红磷的着火点比木炭低 D、由图3可推出空气中氧气的含量二、非选择题题
-
11. 要探究碳酸亚铁和氧气充分反应后的固体成分,请你参与华雪同学的探究:
【查阅资料】①碳酸亚铁(FeCO3)具有还原性,在空气中灼烧生成的氧化物和CO2气体.
②FeO是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁,四氧化三铁能与盐酸反应生成氯化亚铁、氯化铁和水.
③FeCl2能使高锰酸钾溶液褪色,而FeCl3不能;FeCl3溶液中滴加KSCN溶液,溶液变红色,FeCl2溶液中滴加KSCN溶液,溶液不出现红色.
(1)、【猜想与假设】猜想1:固体成分是氧化铁;猜想2:固体成分是四氧化三铁;
猜想3: .
(2)、【活动与探究】连接仪器、装好药品如图所示(加热和固定装置已省略),打开止水夹K,通入氧气,加热玻璃管X.当Y瓶中产生的沉淀不再增加时,停止加热,继续通入氧气至玻璃管冷却.
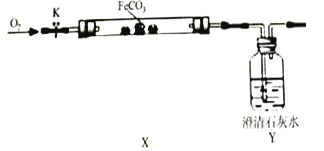
取玻璃管里的少量固体于试管中,滴加盐酸,微热,固体完全溶解.将所得溶液分成甲、乙两份进行实验.
实验编号
实验步骤
实验现象
a
向甲溶液中滴加KSCN溶液
溶液变红色
b
向乙溶液中滴加高锰酸钾溶液
高锰酸钾溶液的紫红色不消失
【结论与反思】①由上述实验现象可知,FeCO3在氧气中高温灼烧得到的固体产物是 , 因此,猜想(填“1”或“2”或“3”)是正确的.
②FeCO3在氧气中高温灼烧的化学方程式为 .
③上述实验(填“a”或“b”)是多余的,因为 .
(3)、【总结与提升】①若实验结束时观察到Y瓶中仍然是澄清的,可能的原因是澄清石灰水的量不足,导致生成的碳酸钙转变成了可溶于水的碳酸氢钙.碳酸氢钙的化学式为 .②CO2使澄清石灰水变浑浊的化学方程式为 .
③华雪同学经过反思,觉得该实验设计还存在问题,因为如果在实验b中观察到 , 就不能确定哪个猜想是正确的.所以华雪同学又对该实验进行了定量探究:取11.6g纯净的碳酸亚铁固体,在空气中高温灼烧至恒重,称得固体质量净减3.6g.通过计算即可确定:FeCO3和氧气充分反应后的固体成分是 .
12. 如图中A﹣I表示初中化学常见的物质,且分别是由一种或两种元素组成:其中A、B、D、H均为单质;F可用作大棚蔬菜生产中的气体肥料;H在B、F、G存在的情况下可以生成铜绿[铜绿主要成分为Cu2(OH)2CO3].图中“﹣﹣”表示两端的物质间能发生化学反应:“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去.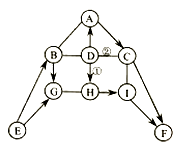 (1)、写出化学式:F , H .(2)、实验室常用E制取B,写出该反应的化学方程式 .(3)、反应①和②的基本反应类型相同,该基本反应类型是 .(4)、写出A→C反应的化学方程式 .13. 学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g平均分成4份进行实验,结果如下:
(1)、写出化学式:F , H .(2)、实验室常用E制取B,写出该反应的化学方程式 .(3)、反应①和②的基本反应类型相同,该基本反应类型是 .(4)、写出A→C反应的化学方程式 .13. 学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g平均分成4份进行实验,结果如下:实验
1
2
3
4
加入样品的质量/g
5
10
15
20
生成的CO2质量/g
1.76
3.52
4.4
m
(1)、上表中m的数值是 .(2)、反应中矿石有剩余是第次实验.(3)、所用稀盐酸的溶质质量分数是多少?