2018年广东省深圳市中考化学冲刺试卷(一)
试卷更新日期:2018-05-23 类型:中考模拟
一、选择题
-
1. 以下是生活常见现象或结论,正确的是( )A、为了加强农作物产量,要尽可能多的使用农药 B、工业排污水会造成水体污染 C、在室内放盆水能防止CO中毒 D、塑料是有机合成材料,不能把它投进带有
 标志的垃圾桶
2. 下列化学用语书写正确的是( )A、三个二氧化硫分子:2SO3 B、两个氧分子:2O C、Co元素的化合价:Na O2 D、一个铝离子:Al+33. 实验操作错误的是( )A、
标志的垃圾桶
2. 下列化学用语书写正确的是( )A、三个二氧化硫分子:2SO3 B、两个氧分子:2O C、Co元素的化合价:Na O2 D、一个铝离子:Al+33. 实验操作错误的是( )A、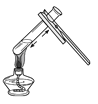 加热液体
B、
加热液体
B、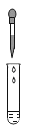 滴加液体
C、
滴加液体
C、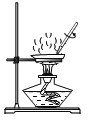 加热蒸发
D、
加热蒸发
D、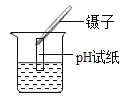 测定溶液pH
4. 有机锗具有抗肿瘤活性,锗元素的部分信息见图,则下列说法错误的是( )
测定溶液pH
4. 有机锗具有抗肿瘤活性,锗元素的部分信息见图,则下列说法错误的是( ) A、X=2 B、该元素相对原子质量为73g C、锗属于金属元素 D、锗原子的中子数为415. 将一定质量的Zn加入到Cu(NO3)2、Mg(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,滤液呈无色,则下列判断正确的是( )。A、反应前后金属固体的质量可能不变 B、向滤液中滴加稀盐酸,可能产生白色沉淀 C、滤液中最多含有三种溶质 D、滤渣一定为Ag、Cu6. 生物体中含有多种氨基酸,下列有关甘氨酸的叙述正确的是( )
A、X=2 B、该元素相对原子质量为73g C、锗属于金属元素 D、锗原子的中子数为415. 将一定质量的Zn加入到Cu(NO3)2、Mg(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,滤液呈无色,则下列判断正确的是( )。A、反应前后金属固体的质量可能不变 B、向滤液中滴加稀盐酸,可能产生白色沉淀 C、滤液中最多含有三种溶质 D、滤渣一定为Ag、Cu6. 生物体中含有多种氨基酸,下列有关甘氨酸的叙述正确的是( )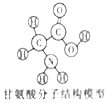 A、甘氨酸是有机高分子化合物 B、甘氨酸中碳原子与氢原子的个数比为24:5 C、甘氨酸是由碳、氢、氧、氮四种原子构成的 D、一个甘氨酸分子中含有10个原子7. 如图是A、B两种固体物质的溶解度曲线,下列说法正确的是( )
A、甘氨酸是有机高分子化合物 B、甘氨酸中碳原子与氢原子的个数比为24:5 C、甘氨酸是由碳、氢、氧、氮四种原子构成的 D、一个甘氨酸分子中含有10个原子7. 如图是A、B两种固体物质的溶解度曲线,下列说法正确的是( )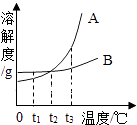 A、A的溶解度都大于B的溶解度 B、t1℃时,用等量水分别制成的A、B饱和溶液中,A的质量比B大 C、t2℃时,A、B两种饱和溶液中,溶质的质量分数相等 D、A、B两种饱和溶液都从t3℃降温到t2℃,析出的晶体一定等质量8. 设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的是( )
A、A的溶解度都大于B的溶解度 B、t1℃时,用等量水分别制成的A、B饱和溶液中,A的质量比B大 C、t2℃时,A、B两种饱和溶液中,溶质的质量分数相等 D、A、B两种饱和溶液都从t3℃降温到t2℃,析出的晶体一定等质量8. 设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的是( )编号
A
B
C
D
实验设计
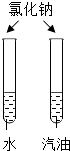

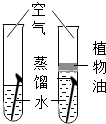
实验目的
探究同种物质在不同溶剂中的溶解性
探究物质燃烧的条件
探究铁生锈的条件
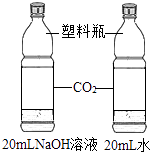
探究CO2与NaOH溶液能否发生反应
A、A B、B C、C D、D9. 现有以下曲线,与之对应的叙述正确的是( )
A、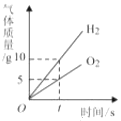 电解水一段时间
B、
电解水一段时间
B、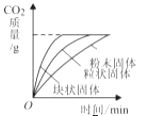 等质量的三种碳酸钙分别与足量的同浓度稀盐酸反应
C、
等质量的三种碳酸钙分别与足量的同浓度稀盐酸反应
C、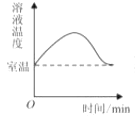 硝酸铵溶于水时,溶液温度的变化
D、
硝酸铵溶于水时,溶液温度的变化
D、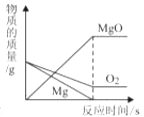 等质量的镁和氧气,充分反应
10. 下列除杂质所选用的试剂及实验操作均正确的是( )
等质量的镁和氧气,充分反应
10. 下列除杂质所选用的试剂及实验操作均正确的是( )选项
物质(括号内为杂质)
除杂试剂
实验操作
A
铁粉(碳粉)
稀HCl
过滤
B
CO2(CO)
O2
点燃
C
KCl (KOH)
稀 H2SO4
蒸发结晶
D
MnO2 (KCl)
水
溶解、过滤
A、A B、B C、C D、D二、非选择题
-
11. 有一包固体混合物粉末,可能含有Na2CO3、Na2SO4、BaSO4、NaCl、CuO中的一种或几种.某研究小组为探究其成分,现按图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全进行).
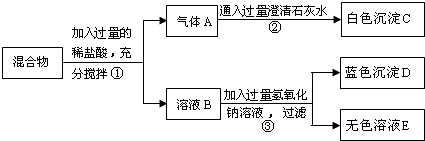
试根据实验过程和发生的现象填写以下空白:
(1)、常温下,气体A水溶液的pH7(填“>”“<”“=”之一),实验步骤②中发生反应的化学方程式为: .(2)、蓝色沉淀D为(写化学式),请写出实验步骤③中发生的任意一个反应的化学方程式 .(3)、根据上述实验,溶液E中一定存在的溶质有(写化学式,下同)、 . 原固体混合物中一定含有的物质为、 , 一定不含 .(4)、要进一步推理固体混合物的成分,可另取少量混合物溶于水,取上层清液进行实验,药品有:[①过量Ba(NO3)2溶液②过量AgNO3溶液③过量稀硝酸]正确的滴加顺序为 .A、①②③ B、③①② C、③②① D、①③②12.请结合下图回答问题:
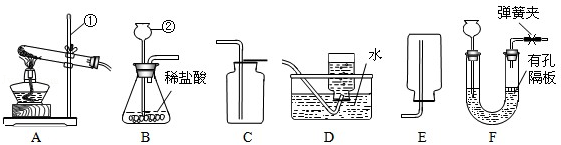
(1)标号①②的仪器名称:① , ② .
(2)实验室选用A、D装置制取O2 , 气体收集完毕时,应先(填“从水中取出导气管”或“熄灭酒精灯”).
(3)实验室可用(NH4)2SO4固体和熟石灰混合加热制取NH3 , 应选择发生装置为(选填序号).
(4)选择发生装置B和收集装置(选填序号)可以用于实验室制取CO2 , 若将发生装置由B改为F,其优点是 .
①为了得到纯净、干燥的CO2 , 除杂装置(如图)的导管按气流方向连接顺序是(选填字母);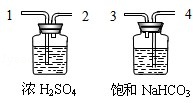
a.1→2→4→3 b.2→1→3→4
c.4→3→1→2 d.3→4→2→1
用化学反应方程式表示饱和NaHCO3溶液的作用 .
②写出用澄清石灰水检验CO2的化学反应方程式 .13. 某同学取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂,如图: (1)、塑料试剂瓶膨胀破裂的原因是 , 反应的化学方程式为 .(2)、破裂后瓶内试剂会吸收空气中CO2生成CaCO3 . 为测定其中CaCO3的质量分数,兴取小组分别进行如下实验:
(1)、塑料试剂瓶膨胀破裂的原因是 , 反应的化学方程式为 .(2)、破裂后瓶内试剂会吸收空气中CO2生成CaCO3 . 为测定其中CaCO3的质量分数,兴取小组分别进行如下实验:实验1:称取10.0g样品,加50.0g水溶解,搅拌、静置、过滤,将沉淀洗涤、干燥、称重.
实验2:称取10.0g样品,向其中加入足量稀盐酸,充分反应,收集产生的气体.
①根据实验1称重计算样品中CaCO3的质量分数可能偏高,原因是 .
②若实验2中收集的气体为2.2g,计算样品中CaCO3的质量分数 . (请写出计算过程)