2015-2016学年山东省济宁市微山一中高一下学期质检化学试卷(普通班)(3月份)
试卷更新日期:2016-12-26 类型:月考试卷
一、选择题
-
1. ﹣NMR(核磁共振)可用于含碳化合物的结构分析, 表示的是( )A、核外有13个电子,其中6个能参与成键 B、核内有6个质子,核外有7个电子 C、质量数是13,原子序数是6,核内有7个质子 D、质量数是13,原子序数是6,核内有7个中子2. 下列各组粒子中属于同位素的是( )A、16O和18O B、H2O和D2O C、H2和D2 D、24Mg和24Na3. 下列说法正确的是( )A、形成离子键的阴阳离子间只存在静电吸引力 B、HF,HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 C、第三周期非金属元素含氧酸的酸性从左到右依次增强 D、元素周期律是元素原子核外电子排布周期性变化的结果4. 已知同周期X,Y,Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4 , 则下列判断中正确的是( )A、单质的氧化性按X,Y,Z的顺序增强 B、阴离子的还原性按X,Y,Z的顺序减弱 C、气态氢化物的稳定性按X,Y,Z的顺序增强 D、元素非金属性按X,Y,Z的顺序减弱5. 下列物质中既有离子键又有非极性共价键的化合物是( )A、H2SO4 B、NaOH C、N2 D、Na2O26. 下列反应既属于氧化还原反应,又是吸热反应的是( )A、锌粒与稀硫酸的反应 B、灼热的木炭与CO2的反应 C、甲烷在空气中燃烧的反应 D、Ba(OH)2•8H2O晶体与NH4Cl晶体的反应7. 关于离子键、共价键的各种叙述中,下列说法正确的是( )A、在离子化合物里,只存在离子键,没有共价键 B、非极性键只存在于双原子的单质分子(如Cl2)中 C、在共价化合物分子内,一定不存在离子键 D、由不同元素组成的多原子分子里,一定只存在极性键8. 下列各组中,性质比较不正确的是( )A、酸性:HClO4>HBrO4>HIO4 B、碱性:NaOH>Mg(OH)2>Al(OH)3 C、稳定性:PH3>H2S>HCl D、非金属性:F>O>S9. 已知2H2+O2 2H2O.下列关于该反应的说法中错误的是( )
①该反应是一个放热反应 ②参加反应的氢气和氧气的总能量高于反应生成的水的总能量 ③该反应是一个吸热反应 ④参加反应的氢气和氧气的总能量低于反应生成的水的总能量.
A、①② B、①④ C、②③ D、③④10. 下列分子的电子式书写正确的是( )A、MgCl2 B、CCl4
B、CCl4 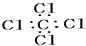 C、CO2
C、CO2 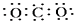 D、Na2O
D、Na2O 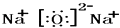 11. 在周期表中,金属元素和非金属元素的分界线附近能找到( )A、制农药的元素 B、制催化剂的元素 C、制半导体的元素 D、制耐高温合金材料的元素12. 下列过程中,共价键被破坏的是( )A、碘升华 B、溴蒸气被木炭吸附 C、酒精溶于水 D、HCl气体溶于水13. 砹(At)是卤素中核电荷数最大的元素,推测砹或砹的化合物性质的叙述中正确的是( )A、砹为有色固体 B、HAt 很稳定 C、AgAt易溶于水 D、砹单质的熔沸点比碘单质的熔沸点低14. 短周期金属元素甲~戊在元素周期表中的相对位置如图所示.下列判断正确的是( )
11. 在周期表中,金属元素和非金属元素的分界线附近能找到( )A、制农药的元素 B、制催化剂的元素 C、制半导体的元素 D、制耐高温合金材料的元素12. 下列过程中,共价键被破坏的是( )A、碘升华 B、溴蒸气被木炭吸附 C、酒精溶于水 D、HCl气体溶于水13. 砹(At)是卤素中核电荷数最大的元素,推测砹或砹的化合物性质的叙述中正确的是( )A、砹为有色固体 B、HAt 很稳定 C、AgAt易溶于水 D、砹单质的熔沸点比碘单质的熔沸点低14. 短周期金属元素甲~戊在元素周期表中的相对位置如图所示.下列判断正确的是( )甲
乙
丙
丁
戊
A、原子半径:丙<丁<戊 B、金属性:甲>丙 C、氢氧化物碱性:丙>丁>戊 D、最外层电子数:甲>乙15. 物质的量相同的Mg2+、F﹣、H2O三种微粒,一定含有相同的( )A、电子数 B、质子数 C、中子数 D、质量数16. 下列粒子半径之比小于1的是( )A、 B、 C、 D、17. 某粒子用 表示,下列关于该粒子的叙述中正确的是( )A、所含质子数=A﹣n B、所含中子数=A﹣Z C、所含电子数=A+n D、所含质子数=A+Z18. 依据元素周期表及元素周期律,下列推断正确的是( )A、H2SiO3的酸性比H2CO3的强 B、Mg(OH)2的碱性比Be(OH)2的强 C、HF,HCl、HBr、HI的热稳定性依次增强 D、若M+和R2﹣的核外电子层结构相同,则原子序数:R>M19. 短周期元素的离子aW3+、bX+、cY2﹣、dZ﹣都具有相同的电子层结构,下列关系正确的是( )A、质子数:c>d B、离子的还原性:Y2﹣>Z﹣ C、氢化物的稳定性:H2Y>HZ D、原子半径:X<W20. 氢气在氯气中燃烧时发出苍白色火焰,在反应过程中,破坏1mol氢气中的化学键消耗的能量为a kJ,破坏1mol氯气中的化学键消耗的能量为b kJ,形成1mol HCl中的化学键释放的能量为c kJ,下列关系中正确的是( )A、b>c B、a+b>2c C、a+b<c D、a+b<2c二、非选择题
-
21. 写出元素在周期表中的位置,离子结构示意图以及粒子半径大小比较(1)、Al元素在周期表中的位置;S元素在周期表中的位置 .(2)、S2﹣电子式(3)、粒子半径比较:Mg2+O2﹣ , Mg2+Ca2+ .22. 下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
族周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
1
A
B
2
D
E
F
G
3
C
H
I
(1)、C的离子结构示意图为 , I的原子结构示意图 .(2)、在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为;该物质溶于水后的溶液呈性(填“酸”、“碱”或“中”).(3)、元素的最高价氧化物对应的水化物中,碱性最强的是 , 该碱化学键类型 , 酸性最强的是 , 呈两性的是 .(4)、A分别与D,E,F,G H形成的化合物的稳定性顺序为: .23. A,B,C,D 4种元素的核电荷数依次增加,它们的离子电子层数相同且最外层电子数均为8.A原子的L层电子数与K,M层电子数之和相等,D原子的K,L层电子数之和等于电子总数的一半.B,C原子能形成CB型离子化合物,回答下列问题:(1)、A元素的符号是:A(2)、A,B,C,D原子半径由大到小的顺序是 .(3)、B与D两种元素形成化合物的化学式 , 电子式为 , 属于化合物.24. A,B,C,D四种短周期元素,原子序数D>A>B>C,且A,B同周期,C,D同主族,A的原子结构示意图为: ,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空: (1)、A的元素名称为 , 其气态氢化物的稳定性比CH4(填“强”或“弱”).(2)、C,D的最高价氧化物的水化物的酸性大小为>(填化学式).(3)、B的活泼性比钙的(填“强”或“弱”).(4)、写出C的气态氢化物与其最高价氧化物对应的水化物反应 .
,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空: (1)、A的元素名称为 , 其气态氢化物的稳定性比CH4(填“强”或“弱”).(2)、C,D的最高价氧化物的水化物的酸性大小为>(填化学式).(3)、B的活泼性比钙的(填“强”或“弱”).(4)、写出C的气态氢化物与其最高价氧化物对应的水化物反应 .