四川省绵阳市安州区2017-2018学年中考化学二模考试试卷
试卷更新日期:2018-05-18 类型:中考模拟
一、单选题
-
1. 化学与人类生产、生活密切相关。下列应用不涉及化学变化的是( )A、工业上用稀盐酸除铁锈 B、生活中用纯碱去除发面团中的酸味 C、工业上通过分离液态空气得到氧气 D、生活中生石灰用作袋装食品干燥剂2. 下列化学实验操作正确的是( )A、
 稀释浓硫酸
B、
稀释浓硫酸
B、 检查气密性
C、
检查气密性
C、 过滤
D、
过滤
D、 测定pH
3. 2017年1月1日起,十二届全国人大常委会通过的史上最严厉的“环保法”开始实施。保护环境利在千秋,功在当代。为了保护环境,你认为下列措施切实可行的是( )
测定pH
3. 2017年1月1日起,十二届全国人大常委会通过的史上最严厉的“环保法”开始实施。保护环境利在千秋,功在当代。为了保护环境,你认为下列措施切实可行的是( )①秸秆回收利用,不露天焚烧。②为治理雾霾,禁止使用化石燃料 ③使用风力、水力发电代替火力发电。④将垃圾分类回收利用 ⑤城市道路使用太阳能景观灯,节能又环保
A、②③④⑤ B、①③④⑤ C、①③⑤ D、①②③④⑤4. “推理”是化学学习过程中常用的思维方法,现有以下推理,其中正确的是( )
A、因为碱的溶液呈碱性,所以呈碱性的溶液一定是碱的溶液 B、单质中只含有一种元素,所以只含有一种元素的物质一定是单质 C、化合物是由不同种元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物 D、在同一化合物中,正负化合价的代数和为零,金属元素显正价,所以非金属元素一定显负价5. 目前世界上最精确的钟是以锶做钟摆的钟,锶的原子结构示意图及元素周期表中某些信息如图所示,下列说法正确的是( ) A、x的值为8 B、锶原子在化学反应中易失去电子 C、锶的相对原子质量为87.62g D、锶属于非金属元素6. 甲、乙两种物质的溶解度曲线如图1所示。下列说法中正确的是( )
A、x的值为8 B、锶原子在化学反应中易失去电子 C、锶的相对原子质量为87.62g D、锶属于非金属元素6. 甲、乙两种物质的溶解度曲线如图1所示。下列说法中正确的是( )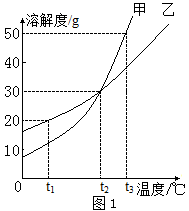 A、t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液 B、t2℃时,甲、乙饱和溶液的溶质质量分数都为30% C、t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和 D、t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙7. 化学学习让我们有了很多收获,下列对某一主题的知识归纳,完全符合题意的一组是( )
A、t1℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液 B、t2℃时,甲、乙饱和溶液的溶质质量分数都为30% C、t2℃时,甲、乙的饱和溶液分别降温至t1℃,甲溶液饱和,乙溶液不饱和 D、t2℃时,质量相同的甲、乙饱和溶液分别升温至t3℃,为达饱和状态,需加入甲的质量大于乙7. 化学学习让我们有了很多收获,下列对某一主题的知识归纳,完全符合题意的一组是( )A.物质鉴别
B.物质除杂
硫酸钾和硫酸铵——熟石灰混合研磨、闻气味
羊毛纤维与合成纤维——灼烧、闻气味
鉴别 CaCO3、NaOH、NaCl、NH4NO3 四种固体——加水溶解
除去KCl粉末中的少量KClO3——加入二氧化锰,加热除去CO2中的少量CO——将气体缓缓通过灼热的氧化铜
C.化学与生活
D.化学用语中数字的含义
①青少年正在长身体,应多吃富含蛋白质的肉类,不吃蔬菜②地沟油经化学方法处理制成航空燃油,实现变废为宝
③生活中常用的塑料、纤维、合金、玻璃等都是有机合成材料
①H2O:一个水分子含有两个氢原子
②Ca2+:一个钙离子带有两个单位正电荷
③S2﹣:硫元素的化合价为负二价
A、A B、B C、C D、D8. 大数据处理能及时获得更多的信息,下列图象能正确反映对应变化关系的是( )
A、 表示KMnO4加热制O2生成的MnO2的质量与时间的关系图
B、
表示KMnO4加热制O2生成的MnO2的质量与时间的关系图
B、 表示CO还原CuO的实验中,试管内的固体质量与时间的关系图
C、
表示CO还原CuO的实验中,试管内的固体质量与时间的关系图
C、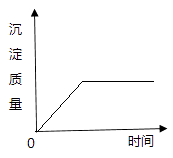 表示向Ca(NO3)2(含少量HCl)溶液中滴加K2CO3溶液,沉淀质量与时间的关系图
D、
表示向Ca(NO3)2(含少量HCl)溶液中滴加K2CO3溶液,沉淀质量与时间的关系图
D、 表示向足量的稀HCl中加入少量Fe,溶液质量与时间的关系图
表示向足量的稀HCl中加入少量Fe,溶液质量与时间的关系图
二、填空题
-
9. 某城市自来水的处理过程如图所示:
 (1)、Ⅰ 步骤①网格净水原理类似于步骤 。(选填图中②~⑤的序号)。(2)、Ⅱ 步骤②所起的作用是________(选填字母)。A、杀死水中的细菌 B、减少水中氧气 C、使泥沙沉积至底部 D、分解有毒物质(3)、Ⅲ 生活中将自来水软化的常用方法是。在蒸馏水中加入肥皂水搅拌后的现象是。10. 由于高铁列车车厢是密闭的空间,因此提供清洁空气、保持车厢内卫生非常重要。
(1)、Ⅰ 步骤①网格净水原理类似于步骤 。(选填图中②~⑤的序号)。(2)、Ⅱ 步骤②所起的作用是________(选填字母)。A、杀死水中的细菌 B、减少水中氧气 C、使泥沙沉积至底部 D、分解有毒物质(3)、Ⅲ 生活中将自来水软化的常用方法是。在蒸馏水中加入肥皂水搅拌后的现象是。10. 由于高铁列车车厢是密闭的空间,因此提供清洁空气、保持车厢内卫生非常重要。①高铁酸钠(Na2FeO4)是高铁上常用的一种“绿色环保高效”消毒剂。请标出高铁酸钠中铁元素的化合价;
②某品牌的空气净化剂含有过氧化钠(Na2O2),它可以使车厢里的二氧化碳转化为碳酸钠和氧气,写出其化学反应方程式。
11. 根据化学性质不同,氧化物主要可分为酸性氧化物、碱性氧化物、两性氧化物和不成盐氧化物。凡能跟碱反应,生成盐和水的氧化物叫酸性氧化物;能跟酸反应,生成盐和水的氧化物,叫做碱性氧化物。Al2O3是一种两性氧化物,它可发生如下化学反应:Al2O3 + 6HCl ═ 2AlCl3 + 3H2O; Al2O3+ 2NaOH ═ 2NaAlO2 + H2O
请回答下列问题:
①下列氧化物中,属于酸性氧化物的是 。(填字母编号)
A.H2O
B.CO
C.SO2
D.Fe2O3
②NaAlO2的名称是偏铝酸钠,它属于 (选填“酸”、“碱”、“盐”或“氧化物”),偏铝酸钠电离时产生的阴离子是(填离子符号)。
三、推断题
-
12. 几种物质之间的转化关系如图所示,部分产物和反应条件已省去。请回答下列问题:
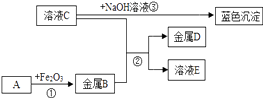
Ⅰ 金属B的活动性金属D的活动性(填“>”、“<”、“=”);
Ⅱ 若A是一种气体化合物,写出①的化学方程式:;
Ⅲ 向C溶液中加入AgNO3溶液,有白色沉淀,加入稀硝酸,沉淀不溶解,写出其化学反应方程式:;
Ⅳ 写出溶液C与NaOH溶液反应的基本类型:。
四、实验题
-
13. 双氧水常用于消毒、漂白等,它是过氧化氢(H2O2)的水溶液。含过氧化氢30%的溶液以二氧化锰为催化剂可迅速分解出氧气。现欲制干燥而又纯净的氧气,可采用如右图装置:装置A中,锥形瓶内盛的是二氧化锰,分液漏斗内盛的是30%的过氧化氢溶液。
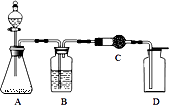
①写出过氧化氢制取氧气的化学反应方程式 , 装置B中的药品是 , 作用是。
②装置C可用来检验氧气是否干燥,则其中的药品是 , 证明氧气已干燥的现象是。
③装置D中氧气是否集满的检验方法是。
五、科学探究题
-
14. 实验探究是化学研究的常用手段。
(1)、初中化学课上,同学们利用如图实验探究碱的化学性质
①A实验中滴加酚酞的作用是:;
②B实验中观察到的现象为:;
③C实验中反应的化学方程式为:。
(2)、【实验再探究】实验结束后,同学们将废液倒入同一只废液缸中,发现废液浑浊并显红色。【提出问题】废液中含有什么物质?
【假设猜想】通过分析上述实验,同学们猜想:废液中除酚酞、碳酸钙及水以外一定含有。
老师问:废液中还可能含有什么物质?引发了同学们热烈讨论,下面是大家的发言:
学生甲
可能含有Ca(OH)2
学生乙
可能含有Na2CO3
学生丙
可能含有CaCl2
学生乙
可能含有
(3)、【实验验证】同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钡溶液,得到白色沉淀,红色褪去。【结论】上述滤液中,还含有 , 没有。
(4)、【实验反思】①根据以上B实验可知,氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式:;
②现有一瓶长期敞口放置的氢氧化钠溶液,它的变质程度如何呢?
(5)、【查阅资料】Ⅰ氯化钙溶液呈中性。Ⅱ氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3═CaCO3↓+2NaCl
为了弄清久置的氢氧化钠是否完全变质,设计了如下方案:
实验步骤
实验现象
实验结论
①取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡
有生成
说明原溶液中一定有碳酸钠
②取步骤①试管中的少量上层清液,滴加酚酞溶液
溶液变红色
说明原溶液中一定有
(6)、【实验结论】该氢氧化钠溶液(填“部分”或“全部”)变质。
(7)、【反思与评价】在上述实验步骤①中,小强提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案(填“可行”或“不可行”)。
六、计算题
-
15. 现有硫酸和硫酸铜的混合溶液200g,向该溶液中逐滴加入质量分数为10%的氢氧化钠溶液直至生成Cu(OH)2沉淀,沉淀质量与所加入的氢氧化钠溶液的质量关系如图所示。计算:
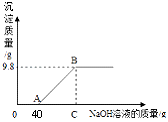 (1)、Cu(OH)2的相对分子质量是 。(2)、生成最大沉淀量时(即B点),所加入的氢氧化钠溶液的总质量。。(3)、求B点时,反应后溶质质量分数是多少?(保留两位有效数字)。
(1)、Cu(OH)2的相对分子质量是 。(2)、生成最大沉淀量时(即B点),所加入的氢氧化钠溶液的总质量。。(3)、求B点时,反应后溶质质量分数是多少?(保留两位有效数字)。
-
-
-