江苏省扬州市高邮2017-2018学年中考化学一模考试试卷
试卷更新日期:2018-05-11 类型:中考模拟
一、单选题
-
1. “千年古盂城,诗画高邮湖”,为提升城市品味,下列措施有利于“创建国家级文明城市”的是( )A、钢厂的废气在夜间排放,并且增高排放烟囱的高度 B、化工厂的废水运送到东部的荡滩再排放 C、积极推行“燃煤企业和餐饮宾馆的炉灶改为燃烧天然气” D、“能开车就不步行”提高出行效率,也能彰显城市发达程度2. 清澈的湖水属于( )A、纯净物 B、氧化物 C、混合物 D、有机物3. 徜徉在数千亩油菜开花的田垄间,闻到阵阵的花香,主要是因为( )
 A、分子之间有较大的间隙 B、分子非常的微小 C、分子不断的运动 D、分子结构在阳光下发生了分解4. 开幕式上空漂浮的气球,是将传统的“氢气球”改用为“氦气球”。相关说明合理的是( )A、两种气体的密度都比空气密度小,但氦气更安全 B、氢气球具有可燃性,气球爆炸场面更震撼 C、氢气是由分子构成的,氦气由原子构成的。用由原子构成的气体比较好 D、氦气属于稀有气体的一种,在空气中体积含量约占21%5. 园内的小火车深受小游客的青睐,小火车的底部是“钢质”材料,内部的小座椅是玻璃钢,透明窗户是有机玻璃,下列关于材料的说法科学的是( )
A、分子之间有较大的间隙 B、分子非常的微小 C、分子不断的运动 D、分子结构在阳光下发生了分解4. 开幕式上空漂浮的气球,是将传统的“氢气球”改用为“氦气球”。相关说明合理的是( )A、两种气体的密度都比空气密度小,但氦气更安全 B、氢气球具有可燃性,气球爆炸场面更震撼 C、氢气是由分子构成的,氦气由原子构成的。用由原子构成的气体比较好 D、氦气属于稀有气体的一种,在空气中体积含量约占21%5. 园内的小火车深受小游客的青睐,小火车的底部是“钢质”材料,内部的小座椅是玻璃钢,透明窗户是有机玻璃,下列关于材料的说法科学的是( ) A、玻璃钢与钢是同类材料 B、钢属于无机材料 C、有机玻璃属于复合材料 D、玻璃钢属于合成材料6. 小火车轨道焊接发生了如下的化学反应: 2Al +Fe2O3 2Fe +Al2O3。下列说法错误的是( )
A、玻璃钢与钢是同类材料 B、钢属于无机材料 C、有机玻璃属于复合材料 D、玻璃钢属于合成材料6. 小火车轨道焊接发生了如下的化学反应: 2Al +Fe2O3 2Fe +Al2O3。下列说法错误的是( )
A、Fe2O3的名称是氧化铁 B、Fe2O3是黑色固体 C、反应中会放出大量的热,使铁熔化 D、该反应属于置换反应7. “无焰食品加热器”给户外活动带来极大的便利,加热器内的物质有镁粉、氯化钠、铁粉,需要加热的时候加入少量的水,加热器就开启工作模式。下列推论合理的是( )A、金属粉与水的反应是吸热反应 B、该反应是利用热能转化为化学能 C、加入氯化钠是为了促进反应的进行 D、上述涉及的物质共含有4种元素8. 为达到“生态旅游,保护环境”,旅游局要定期检查湖水的水质,包括酸碱度检测、溶氧量检测等,下列说法正确的是( )A、用紫色石蕊试液检测湖水的酸碱度 B、溶氧量不足会导致水体缺氧,湖泊生态系统失衡 C、正常湖水的pH略微小于7,是因为空气中二氧化硫溶解于水中 D、船只运行中产生的废水废油可以直接排放湖中9. 邮城八景之一的“杨柳堤岸“在春暖花开的时节会柳絮飞扬。为减少柳絮,园林工人将赤霉酸(C19H22O6),注入柳树。关于赤霉酸的说法正确的是( )A、赤霉酸由47个原子构成 B、氢、氧元素质量比11∶3 C、氢元素的质量分数最大 D、相对分子质量为34610. 油菜的茂盛生长需要补充氮肥,下列可以作为有机氮肥的是( )A、KNO3 B、Ca3(PO4)2 C、NH4HCO3 D、CO(NH2)211. 下列物质酸性最强的是( )A、血液 pH为7.35-7.45 B、胃液 pH为0.8-1.5 C、牛奶 pH为6.3-6.6 D、苹果汁 pH为2.9-3.312. 下列说法正确的是( )A、泥土分散到水中形成溶液 B、医用生理盐水的溶质是葡萄糖 C、牛奶属于悬浊液 D、家用洗涤精去油污属于乳化现象13. 下列鉴别或除杂方法不可行的是( )A、用燃着的小木条鉴别O2和N2 B、用水鉴别NaOH固体和CaCO3固体 C、用酚酞试液鉴别稀硫酸和碳酸钠溶液 D、用稀硫酸除去铁粉中混有的少量铜粉14. 下列实验现象的描述正确的是( )A、灼燃棉纱线,有烧焦的羽毛味 B、铜片投入稀硫酸,不产生气泡 C、红磷在空气中燃烧,生成P2O5 D、加热“铜绿”,固体由绿色变红亮色15. 在某H2O2溶液中氢元素与氧元素的质量比为2∶17,现向19 g该H2O2溶液中加入1 g二氧化锰,充分反应后,生成氧气的质量为( )A、1 g B、1.6 g C、2 g D、8.5 g16. 下列各组变化中,每一转化在一定条件下均能一步实现的是( )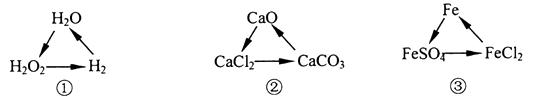 A、①② B、②③ C、①③ D、①②③17. 下列四个图象分别对应四种实验操作过程,其中正确的是( )
A、①② B、②③ C、①③ D、①②③17. 下列四个图象分别对应四种实验操作过程,其中正确的是( )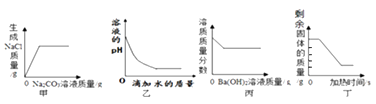 A、甲表示向一定质量的盐酸和氯化钙的混合溶液中逐滴加入碳酸钠溶液至过量 B、乙表示向稀硫酸中加水 C、丙表示向一定质量的稀硫酸中逐滴加入氢氧化钡溶液至过量 D、丁表示加热一定质量的高锰酸钾
A、甲表示向一定质量的盐酸和氯化钙的混合溶液中逐滴加入碳酸钠溶液至过量 B、乙表示向稀硫酸中加水 C、丙表示向一定质量的稀硫酸中逐滴加入氢氧化钡溶液至过量 D、丁表示加热一定质量的高锰酸钾二、多选题
-
18. 通过下列实验操作目的不能达到或表述错误的是( )A、
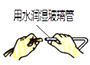 便于套橡胶管
B、
便于套橡胶管
B、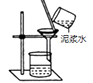 所得的液体为纯净物
C、
所得的液体为纯净物
C、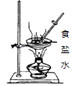 原理是利用了氯化钠的沸点比水高
D、
原理是利用了氯化钠的沸点比水高
D、 配制10%的食盐水
19. 下图为某反应的微观示意图,其中不同的球代表不同元素的原子.下列说法错误的是( )
配制10%的食盐水
19. 下图为某反应的微观示意图,其中不同的球代表不同元素的原子.下列说法错误的是( ) A、反应物甲的每个分子含有5个原子 B、乙中元素的化合价在反应前后未改变 C、生成物的分子个数比为1∶2 D、该反应前后分子种类和数目都发生了变化20. 化肥厂生产合成氨的原料是煤、空气、水。生产简要流程如下:
A、反应物甲的每个分子含有5个原子 B、乙中元素的化合价在反应前后未改变 C、生成物的分子个数比为1∶2 D、该反应前后分子种类和数目都发生了变化20. 化肥厂生产合成氨的原料是煤、空气、水。生产简要流程如下: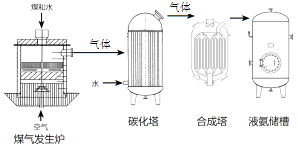
已知:Ⅰ.煤气发生炉中主要反应有:
① C + O2 CO2; ② C + H2O CO + H2
Ⅱ.将合成的氨气部分通入碳化塔,既除去了二氧化碳又得到了化肥NH4HCO3下列说法正确的是( )
A、该合成氨工艺的产品只有液氨和碳酸氢铵 B、氨气有刺激性气味,能使湿润的蓝色石蕊试纸变红 C、煤气发生炉必须保持较高的炉温 D、碳化塔中发生反应的方程式可以表示为NH3+H2O+CO2=NH4HCO3 , 塔内温度应较低三、简答题
-
21. 阅读下列片段,用化学用语回答相关问题
爆竹的主要成分有硫磺、木炭粉、硝酸钾,有的还含有氯酸钾。制作闪光雷、电光炮、烟花炮、彩色焰火时,还要加入镁粉、铁粉、铝粉及无机盐。加入钡盐火焰呈绿色、钠盐火焰呈黄色。当烟花爆竹点燃后,木炭粉、硫磺粉、金属粉末等迅速燃烧,产生二氧化碳、一氧化碳、二氧化硫、一氧化氮、二氧化氮等气体及金属氧化物的粉尘,同时产生大量光和热、而引起鞭炮爆炸。
 (1)、爆竹中的硝酸钾是由K+ 和组成(填离子符号),烟花爆竹产生“耀眼白光”的现象的化学方程式 , 实验室用氯酸钾(二氧化锰做催化剂)制取氧气的化学反应方程式。(2)、硫磺燃烧的化学方程式 , 木炭粉不完全燃烧的化学方程式。(3)、2018年春节市政府下达“禁止燃放烟花爆竹”文件,下列解释理由合理的是_____A、燃放会产生噪音污染 B、燃放会产生粉尘污染 C、一定程度上加剧酸雨的形成22. 松花蛋是春节常见的食品,生石灰、食盐、纯碱是制作松花蛋的主要原料,制作料泥时将上述原料加入水中,混合均匀即可。
(1)、爆竹中的硝酸钾是由K+ 和组成(填离子符号),烟花爆竹产生“耀眼白光”的现象的化学方程式 , 实验室用氯酸钾(二氧化锰做催化剂)制取氧气的化学反应方程式。(2)、硫磺燃烧的化学方程式 , 木炭粉不完全燃烧的化学方程式。(3)、2018年春节市政府下达“禁止燃放烟花爆竹”文件,下列解释理由合理的是_____A、燃放会产生噪音污染 B、燃放会产生粉尘污染 C、一定程度上加剧酸雨的形成22. 松花蛋是春节常见的食品,生石灰、食盐、纯碱是制作松花蛋的主要原料,制作料泥时将上述原料加入水中,混合均匀即可。 (1)、原料中可以做干燥剂的物质是(填化学式),此物质接触到水会发生化学反应,反应的方程式为。(2)、原料中在生活中最常用作防腐剂、调味品,国家强制在其中加入碘酸钾(KIO3),请标出碘酸钾中碘元素的化合价 , 成年人缺乏碘元素会患有。(3)、“纯碱”是(填物质的名称)的俗称,制作料泥时会发生复分解反应,其反应的化学方程式为。(4)、鸭蛋变成松花蛋属于变化(填“物理”或“化学”)。23. 2017年《科学报告》一篇文章称,只需在普通口罩上添加氯化钠涂层,就能将其转化为“特效口罩”。口罩使用过程中,涂层中的氯化钠会溶解于病毒自身携带的水中,形成溶液,杀死病毒;杀死病毒后,水分蒸发,氯化钠再次析出。
(1)、原料中可以做干燥剂的物质是(填化学式),此物质接触到水会发生化学反应,反应的方程式为。(2)、原料中在生活中最常用作防腐剂、调味品,国家强制在其中加入碘酸钾(KIO3),请标出碘酸钾中碘元素的化合价 , 成年人缺乏碘元素会患有。(3)、“纯碱”是(填物质的名称)的俗称,制作料泥时会发生复分解反应,其反应的化学方程式为。(4)、鸭蛋变成松花蛋属于变化(填“物理”或“化学”)。23. 2017年《科学报告》一篇文章称,只需在普通口罩上添加氯化钠涂层,就能将其转化为“特效口罩”。口罩使用过程中,涂层中的氯化钠会溶解于病毒自身携带的水中,形成溶液,杀死病毒;杀死病毒后,水分蒸发,氯化钠再次析出。 (1)、钠原子转化为钠离子,其核外电子数(填“变大”或“变小”),常温下,氯化钠的饱和溶液中,氯化钠与水的质量比为(已知:常温下,氯化钠的溶解度为36g)。(2)、构成氯化钠的阳离子符号为 , 口罩使用过程中,氯化钠溶液中溶质质量分数(填“改变”或“不变”)。
(1)、钠原子转化为钠离子,其核外电子数(填“变大”或“变小”),常温下,氯化钠的饱和溶液中,氯化钠与水的质量比为(已知:常温下,氯化钠的溶解度为36g)。(2)、构成氯化钠的阳离子符号为 , 口罩使用过程中,氯化钠溶液中溶质质量分数(填“改变”或“不变”)。四、实验题
-
24. 请结合下图回答问题:
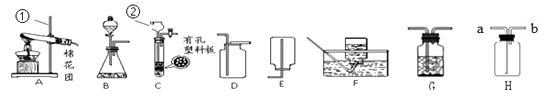 (1)、写出图中有标号仪器的名称:① , ② 。(2)、用加热高锰酸钾的方法制取氧气,应选用的发生装置是(填字母编号) , 装入药品前应先 , 写出该反应化学方程式。(3)、用B、D装置组合制取二氧化碳气体的化学方程式。 若要获得干燥的该气体,除发生、收集装置外,还应选用G装置,并在该装置中盛放(填名称)。如果用H装置收集该气体,则气体从端进入(填“a”或“b”)。(4)、实验室用锌粒和稀硫酸反应制取H2的化学方程式 , 常选用装置B或C, C与B相比较,C的优点是。(5)、实验室使用的稀硫酸通常都是将浓硫酸用水稀释而成的。现欲用98%的硫酸(密度为1.84g/mL)配置19.6%的稀硫酸100 g,需要浓硫酸的体积为mL(保留到小数点后一位),量取水时应选用规格(从10mL、50mL、100mL中选取)为mL的量筒。稀释浓硫酸的操作为: , 并用玻璃棒不断搅拌。最后将稀硫酸转移到试剂瓶中,贴上标签备用,在标签上可以不必注明的是(填字母序号)。
(1)、写出图中有标号仪器的名称:① , ② 。(2)、用加热高锰酸钾的方法制取氧气,应选用的发生装置是(填字母编号) , 装入药品前应先 , 写出该反应化学方程式。(3)、用B、D装置组合制取二氧化碳气体的化学方程式。 若要获得干燥的该气体,除发生、收集装置外,还应选用G装置,并在该装置中盛放(填名称)。如果用H装置收集该气体,则气体从端进入(填“a”或“b”)。(4)、实验室用锌粒和稀硫酸反应制取H2的化学方程式 , 常选用装置B或C, C与B相比较,C的优点是。(5)、实验室使用的稀硫酸通常都是将浓硫酸用水稀释而成的。现欲用98%的硫酸(密度为1.84g/mL)配置19.6%的稀硫酸100 g,需要浓硫酸的体积为mL(保留到小数点后一位),量取水时应选用规格(从10mL、50mL、100mL中选取)为mL的量筒。稀释浓硫酸的操作为: , 并用玻璃棒不断搅拌。最后将稀硫酸转移到试剂瓶中,贴上标签备用,在标签上可以不必注明的是(填字母序号)。A.100 g
B.19.6%
C.稀硫酸
五、流程题
-
25. 硫铁矿烧渣(主要成分Fe2O3、Fe3O4、FeO、SiO2等,铁的氧化物均能与盐酸反应,SiO2不与酸反应)是工业生产硫酸的废渣,利用硫铁矿烧渣制备铁红(Fe2O3)等产品的部分流程如图所示:
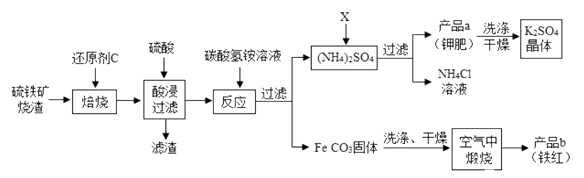 (1)、焙烧时C与O2不完全燃烧产生的气体都能将铁的多种氧化物还原成铁。试写出该气体与Fe3O4反应的化学方程式。(2)、酸浸、过滤后滤液中的溶质主要是。(填化学式)(3)、在空气中煅烧FeCO3即FeCO3与空气中的O2反应生成Fe2O3和CO2 , 试写出该反应的化学反应方程式为:。(4)、若产品a的主要成分是K2SO4 , 得到产品a时加入的试剂X为。由此判断在此条件下K2SO4的溶解度NH4Cl的溶解度(选填“<”或“>”或“=”)。(5)、可选用下列__________(填字母)洗涤产品a。A、KCl饱和溶液 B、水 C、饱和K2SO4溶液.
(1)、焙烧时C与O2不完全燃烧产生的气体都能将铁的多种氧化物还原成铁。试写出该气体与Fe3O4反应的化学方程式。(2)、酸浸、过滤后滤液中的溶质主要是。(填化学式)(3)、在空气中煅烧FeCO3即FeCO3与空气中的O2反应生成Fe2O3和CO2 , 试写出该反应的化学反应方程式为:。(4)、若产品a的主要成分是K2SO4 , 得到产品a时加入的试剂X为。由此判断在此条件下K2SO4的溶解度NH4Cl的溶解度(选填“<”或“>”或“=”)。(5)、可选用下列__________(填字母)洗涤产品a。A、KCl饱和溶液 B、水 C、饱和K2SO4溶液.六、科学探究题
-
26. 鸡蛋主要由蛋壳、蛋壳膜、蛋白、蛋黄等几个部分组成,其中蛋壳的主要成分是CaCO3 , 里面覆盖一层蛋壳膜。化学活动兴趣小组的同学开展了以下探究活动:
【提出问题】蛋壳中的CaCO3含量是多少?

【查阅资料】
a、蛋壳经过科学检测其中含CaCO3的质量分数约为82%~85%,含蛋白质质量分数约14-17%。
b、蛋壳膜中蛋白质含量约为90%~93%。
c、Ba(OH)2是一种碱,化学性质与Ca(OH)2相似。
【设计方案】
方案一:用“灼烧法”,将该蛋壳放在空气中充分灼烧并采集相关数据进行测定。
方案二:用“酸处理法”,将蛋壳与稀盐酸反应后再进行吸收转变为碳酸钡进行测量处理。
【进行实验】
方案一:称取12.0 g蛋壳研磨成粉末置于通风橱中,灼烧至质量不再减少,再称量剩余固体的质量为7.16 g。
方案二:用下图所示的连接实验装置,称取12 g蛋壳样品进行实验(假设其他成分均不与HCl反应,装置内试剂均足量。)
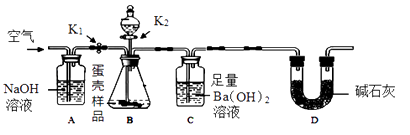 (1)、【实验步骤】
(1)、【实验步骤】① 按上图连接好装置后,并检查装置的气密性;
② 向B装置中加入蛋壳样品后,先通入一会儿空气;
③ 关闭K1 , 打开K2 , 向蛋壳样品中滴入10%的盐酸,直到为止;
④ 关闭K2 , 打开K1 , 再缓缓通入空气一会儿,至装置C中不再产生沉淀为止;
⑤ 将装置C中的固液混合物进行过滤、、烘干后称量其质量;
⑥ 重复上述实验。
(2)、【数据处理】方案一:产生的CO2质量g,蛋壳中的CaCO3的质量分数为%。(保留一位小数)
方案二:重复3次实验,记录数据如下:
实验次数
第1次
第2次
第3次
装置C中沉淀质量(/g)
19.68
19.75
19.67
方案二:实验测得蛋壳中的CaCO3的质量分数(写出计算过程,)
(已知:Mr(CaCO3):100 Mr(BaCO3):197)
(3)、【评价反思】①方案二中装置D的作用是。
②方案一测定值与科学检测的数据有较大误差,主要原因是。
-
-