四川省宜宾市2017-2018学年高三理综-化学一模考试试卷
试卷更新日期:2018-05-08 类型:高考模拟
一、单选题
-
1. 化学与生产、生活密切相关。下列叙述正确的是( )A、14C可用于文物年代的鉴定 B、BaCO3在医学上可用作钡餐 C、明矾可用于饮用水消毒 D、高纯度的SiO2可用于制光电池2. 下列关于正丁烷(b)、2-甲基丙烷(d)、甲苯(p)的说法中正确的是( )A、b与d互为同系物 B、b、d、p的一氯代物种数分别为2、3、4 C、b、d、p均不能使酸性高锰酸钾溶液褪色 D、b、d、p中只有d的所有碳原子不能处于同一平面3. 下列实验操作能达到实验目的的是( )
实验目的
实验操作
A
检验溶液中的Fe2+
先滴加新制氯水,再滴加KSCN溶液
B
配制0.5mol/L的H2SO4溶液
量取50mL1.0 mol/L H2SO4溶液,倒入小烧杯中,再加入50mL水稀释
C
验证乙烯的生成
加热乙醇和浓硫酸混合液,将气体通入酸性KMnO4溶液
D
除去乙酸乙酯中混有的乙酸
用过量饱和碳酸钠溶液洗涤后分液
A、A B、B C、C D、D4. 短周期元素R、T、Q、W在周期表中的相对位置如图所示,其中Q原子的质子数是其最外层电子数的三倍。下列说法正确的是( )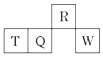 A、原子半径:R>T B、氧化物对应水化物的酸性:W>Q C、最简单气态氢化物的热稳定性:R>Q D、Q与W形成的化合物中,各原子的最外层都满足8电子稳定结构5. NA为阿伏加德罗常数的值。下列说法正确的是( )A、3.6 g D2O中含有的中子数为2NA B、10g C2H4和4g CO组成的混合气体中含有的分子数为0.5NA C、标准状况下,2.24L HF中含有的分子数为0.1NA D、KIO3与HI溶液反应,生成0.1 mol I2转移的电子数为0.2NA6. 用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如下图。下列说法正确的是( )
A、原子半径:R>T B、氧化物对应水化物的酸性:W>Q C、最简单气态氢化物的热稳定性:R>Q D、Q与W形成的化合物中,各原子的最外层都满足8电子稳定结构5. NA为阿伏加德罗常数的值。下列说法正确的是( )A、3.6 g D2O中含有的中子数为2NA B、10g C2H4和4g CO组成的混合气体中含有的分子数为0.5NA C、标准状况下,2.24L HF中含有的分子数为0.1NA D、KIO3与HI溶液反应,生成0.1 mol I2转移的电子数为0.2NA6. 用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,最终可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如下图。下列说法正确的是( )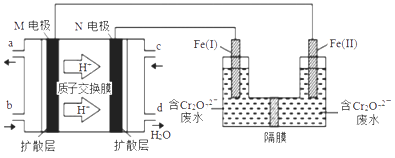 A、Fe(II)为阳极 B、M电极的电极反应式为CH3OH+8OH--6e-= CO32-+6H2O C、电解一段时间后,在Fe(Ⅰ)极附近有沉淀析出 D、电路中每转移6mol电子,最多有1 mol Cr2O72-被还原7. 常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA- , Ⅲ代表A2-)。下列说法正确的是( )
A、Fe(II)为阳极 B、M电极的电极反应式为CH3OH+8OH--6e-= CO32-+6H2O C、电解一段时间后,在Fe(Ⅰ)极附近有沉淀析出 D、电路中每转移6mol电子,最多有1 mol Cr2O72-被还原7. 常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关粒子的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA- , Ⅲ代表A2-)。下列说法正确的是( )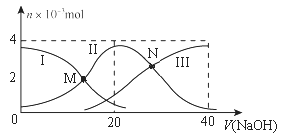 A、M点溶液中:2c(HA-)+c(A2-)=0.2 mol/L B、N点溶液呈酸性,则c(Na+) < 3c(HA-) C、若N点溶液pH =4.2,则Ka2(H2A)的数量级为10−4 D、V(NaOH)=20mL时,溶液中:c(H+) < c(OH-)
A、M点溶液中:2c(HA-)+c(A2-)=0.2 mol/L B、N点溶液呈酸性,则c(Na+) < 3c(HA-) C、若N点溶液pH =4.2,则Ka2(H2A)的数量级为10−4 D、V(NaOH)=20mL时,溶液中:c(H+) < c(OH-)二、填空题
-
8. CuSO4溶液与Na2CO3溶液混合时产生蓝绿色沉淀,某实验小组进行实验,探究蓝绿色沉淀的组成。
【查阅资料】
i.氢氧化铜是一种蓝色絮状沉淀,难溶于水,溶于酸、氨水等,受热会分解。
ii.碳酸铜是蓝绿色粉末状固体,受热易分解,遇水转化为氢氧化铜和碱式碳酸铜的混合物。
iii.碱式碳酸铜呈孔雀绿颜色,又叫孔雀石,难溶于水,溶于酸、氨水等,在空气中加热会分解。
【提出假设】
假设1:沉淀为Cu(OH)2
假设2:沉淀为CuCO3
假设3:沉淀为碱式碳酸铜[化学式可表示为xCuCO3•yCu(OH)2]
(1)、假设1中产生沉淀Cu(OH)2的离子方程式是。(2)、甲同学认为假设2不成立,理由是。(3)、【定性实验】实验小组同学将沉淀从溶液中分离并净化,取少量净化后的固体于试管中,滴加稀硫酸,观察到 , 证明假设3成立。
(4)、【定量实验】为了确定碱式碳酸铜化学式中x与y的关系,实验小组称取净化后的蓝绿色固体m1 g,使用下列装置(夹持仪器未画出)进行实验。
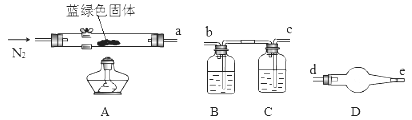
B,C,D中的试剂依次为(填标号)。
a.澄清石灰水
b.碱石灰
c.氯化钙溶液
d.浓硫酸
(5)、各装置接口的连接顺序:a→(填字母序号)。(6)、装置D的作用是。(7)、加热到固体完全分解,硬质玻璃管中得到黑色固体,其余产物被相应装置完全吸收。实验结束后,测得装置B的质量增加m2 g,则xCuCO3•yCu(OH)2中 =(列式表示)。若无D装置,则 的值(填“偏大”或“偏小”或“无影响”)。9. 硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有FeO、CuO、SiO2等杂质)制备ZnSO4·7H2O的流程如下。已知:Ksp[Fe(OH)3]=4.0×10−38 , Ksp[Cu(OH)2]=2.2×10−20
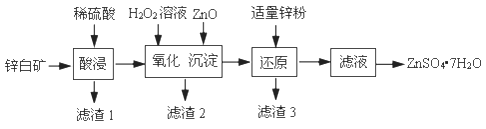 (1)、“滤渣1”的主要成分是(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②(填一种)。(2)、“氧化”过程中,发生氧化还原反应的离子方程式是。(3)、“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是。(4)、加入适量ZnO固体,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且测得沉淀后的溶液中c(Fe3+)=4.0×10−14mol/L,此时溶液中c(Cu2+)的取值范围是mol/L。(5)、加入适量锌粉的作用是。(6)、由滤液得到ZnSO4•7H2O的操作依次为、、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、、。10. 合成氨是人类科学技术上的一项重大突破,对社会发展与进步作出了巨大贡献。(1)、450℃时,在一个体积为2L的恒容密闭容器中充入0.4 mol N2和0.6 mol H2(10min时改变某一条件),测得反应过程中N2、H2和NH3的物质的量随时间变化如下表:
(1)、“滤渣1”的主要成分是(填化学式)。“酸浸”过程中,为了提高锌元素浸出速率,可采取的措施有:①适当提高酸的浓度,②(填一种)。(2)、“氧化”过程中,发生氧化还原反应的离子方程式是。(3)、“沉淀”过程中,加入ZnO产生Fe(OH)3沉淀的原因是。(4)、加入适量ZnO固体,若只析出Fe(OH)3沉淀而未析出Cu(OH)2沉淀,且测得沉淀后的溶液中c(Fe3+)=4.0×10−14mol/L,此时溶液中c(Cu2+)的取值范围是mol/L。(5)、加入适量锌粉的作用是。(6)、由滤液得到ZnSO4•7H2O的操作依次为、、过滤、洗涤、干燥。实验室中过滤操作需要使用的玻璃仪器有烧杯、、。10. 合成氨是人类科学技术上的一项重大突破,对社会发展与进步作出了巨大贡献。(1)、450℃时,在一个体积为2L的恒容密闭容器中充入0.4 mol N2和0.6 mol H2(10min时改变某一条件),测得反应过程中N2、H2和NH3的物质的量随时间变化如下表:时间
物质的量
5 min
10 min
15 min
20 min
25 min
n(N2)/mol
0.36
0.35
0.275
0.25
0.25
n(H2)/mol
0.48
0.45
0.225
0.15
0.15
n(NH3)/mol
0.08
0.1
0.25
0.30
0.30
①5~10 min内,生成NH3的平均反应速率是 mol/(L·min)。
②下列能作为判断该反应达到化学平衡状态的依据是(填字母序号)。
A.v(N2)正=3v(H2)逆
B.容器内压强保持不变
C.容器内混合气体的密度保持不变
D.容器内混合气体的平均相对分子量不变
③第10 min时改变的条件是使用了高效催化剂,理由是。
(2)、合成氨的反应原理为:N2(g)+3H2(g) 2NH3(g) ΔH。相关化学键键能数据如下:
化学键
H—H
N≡N
N—H
E /(kJ/mol)
436
946
391
由此计算ΔH=kJ/mol,低温下,合成氨反应(填“能”或“不能”)自发进行。已知合成氨反应N2(g)+3H2(g) 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g) N2(g)+3H2(g)的活化能Ea2=kJ/mol。
(3)、已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:反应Ⅰ:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =﹣906kJ/mol
反应II:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =﹣1267kJ/mol
①该条件下,N2(g)+O2(g) 2NO(g) △H = kJ/mol
②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2 , 测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应(填“反应Ⅰ”或“反应II”)。520℃时,反应Ⅰ的平衡常数K=(只列算式不计算)。
11. 用还原铁粉制备二茂铁开辟了金属有机化合物研究的新领域。二茂铁甲酰胺是其中一种重要的衍生物,结构如图所示。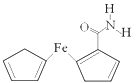 (1)、基态Fe原子价层电子排布式是。(2)、已知二茂铁甲酰胺熔点是176℃,沸点是249℃,难溶于水,易溶于氯仿、丙酮等有机溶剂。据此可推断二茂铁甲酰胺晶体为晶体。(3)、二茂铁甲酰胺中碳原子的杂化方式为 , H、C、N、O四种元素的电负性由大到小的顺序是。(4)、碳、氮元素对应的最简单氢化物分别是CH4和NH3 , 相同条件下CH4的沸点比NH3的沸点(填“高”或“低”),主要原因是。(5)、氢、氮、氧三种元素按照4:2:3的原子个数比形成离子化合物。该离子化合物中,阳离子空间构型是 , 1 mol阴离子含有σ键的数目为。(6)、氮和铁能形成一种磁性材料,其晶胞如图所示,该磁性材料的化学式为。已知晶胞参数为a nm,则该晶胞密度的计算式为ρ=g/cm3(用NA表示阿伏加德罗常数的值)。
(1)、基态Fe原子价层电子排布式是。(2)、已知二茂铁甲酰胺熔点是176℃,沸点是249℃,难溶于水,易溶于氯仿、丙酮等有机溶剂。据此可推断二茂铁甲酰胺晶体为晶体。(3)、二茂铁甲酰胺中碳原子的杂化方式为 , H、C、N、O四种元素的电负性由大到小的顺序是。(4)、碳、氮元素对应的最简单氢化物分别是CH4和NH3 , 相同条件下CH4的沸点比NH3的沸点(填“高”或“低”),主要原因是。(5)、氢、氮、氧三种元素按照4:2:3的原子个数比形成离子化合物。该离子化合物中,阳离子空间构型是 , 1 mol阴离子含有σ键的数目为。(6)、氮和铁能形成一种磁性材料,其晶胞如图所示,该磁性材料的化学式为。已知晶胞参数为a nm,则该晶胞密度的计算式为ρ=g/cm3(用NA表示阿伏加德罗常数的值)。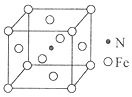 12. 菲索菲那定(E)可用于减轻季节性过敏鼻炎引起的症状,其合成路线如下(其中R—为
12. 菲索菲那定(E)可用于减轻季节性过敏鼻炎引起的症状,其合成路线如下(其中R—为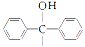 ):
):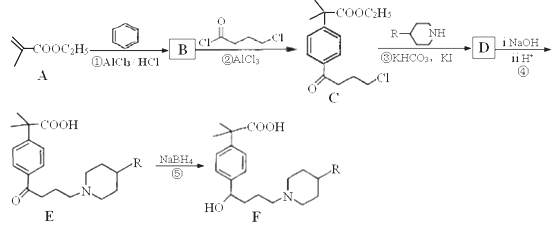 (1)、A的名称是。C中含氧官能团的名称是。(2)、D的结构简式是。(3)、流程图中属于取代反应的是(填数字编号)。(4)、反应②的化学方程式是。(5)、G是B的同系物,分子式为C8H8O2 , G的结构有种。其中,核磁共振氢谱吸收峰面积之比为1:2:2:2:1的结构简式是。(6)、已知:
(1)、A的名称是。C中含氧官能团的名称是。(2)、D的结构简式是。(3)、流程图中属于取代反应的是(填数字编号)。(4)、反应②的化学方程式是。(5)、G是B的同系物,分子式为C8H8O2 , G的结构有种。其中,核磁共振氢谱吸收峰面积之比为1:2:2:2:1的结构简式是。(6)、已知: ,请以丙酮(CH3COCH3)、乙醇为原料制备A,写出相应的合成路线流程图(无机试剂任选)。
,请以丙酮(CH3COCH3)、乙醇为原料制备A,写出相应的合成路线流程图(无机试剂任选)。