四川省内江市2017-2018学年高三理综-化学一模考试试卷
试卷更新日期:2018-05-08 类型:高考模拟
一、单选题
-
1. 我国有着悠久的历史传统文化。下列有关古诗词(句)中蕴含的化学知识分析正确的是( )A、“千淘万漉虽辛苦,吹尽狂沙始到金”,说明金在自然界中以游离态存在,其化学性质稳定 B、“春蚕到死丝方尽,蜡炸成灰泪始干”,其中只有化学变化的过程 C、“纷纷灿烂如星陨,赫赫喧虺似火攻。”,灿烂的烟花是某些金属的焰色反应,属于化学变化 D、“粉身碎骨浑不怕,要留清白在人间”,其中发生的主要化学反应均为氧化还原反应2. 我国科学家屠呦呦因成功提取青蒿素而获得诺贝尔奖。已知青蒿素分子结构如下图所示,下列说法中错误的是( )
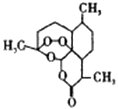 A、青嵩素分子中所有的碳原子不可能在同一平面内 B、青嵩素在酸或碱催化条件下可以水解 C、青蒿素分子含三种官能团,分子结构稳定,受热不易分解 D、青蒿素难溶于水,可采用有机溶剂萃取后蒸馏提取3. 短周期元素X、Y、Z、M的原子序数依次增大,已知元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体。下列叙述错误的是( )A、M元素位于周期表中的第3周期VIA族 B、Z元素最高价氧化物是制造光导纤维的主要原料 C、化合物XM2中含有极性共价键和非极性共价键 D、简单离子半径:Y<M4. 下列实验预期的现象及结论都正确的是( )
A、青嵩素分子中所有的碳原子不可能在同一平面内 B、青嵩素在酸或碱催化条件下可以水解 C、青蒿素分子含三种官能团,分子结构稳定,受热不易分解 D、青蒿素难溶于水,可采用有机溶剂萃取后蒸馏提取3. 短周期元素X、Y、Z、M的原子序数依次增大,已知元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体。下列叙述错误的是( )A、M元素位于周期表中的第3周期VIA族 B、Z元素最高价氧化物是制造光导纤维的主要原料 C、化合物XM2中含有极性共价键和非极性共价键 D、简单离子半径:Y<M4. 下列实验预期的现象及结论都正确的是( )选项
实验
预期现象
预期结论
A
将SO2气体通入Ba(NO3)2溶液中
有白色沉淀生成
H2SO3与Ba(NO3)2发生复分解反应生成BaSO3
B
向盛有KI溶液的试管中,滴加少量新制氯水和CCl4 , 振荡、静置
下层溶液显紫色
Cl2氧化性比I2强
C
铜放入稀硫酸中,无明显现象,再加入硝酸钠固体
溶液变蓝,有明显的气泡放出,铜溶解
硝酸钠可以加快铜与稀硫酸的反应速率,起到了催化剂的作用
D
向FeCl3饱和溶液中逐滴滴入足量浓氨水,并加热至沸腾
生成红褐色透明液体
得到Fe(OH)3胶体
A、A B、B C、C D、D5. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、分子总数为NA的CO、C2H4混合气体其体积约为22.4L,质量为28g B、将1molCl2 通入水中,HClO、Cl-、ClO-粒子数之和为2NA C、2.3克金属钠完全燃烧,转移的电子数为0.1NA D、密闭容器中1molH2(g)与1molI2(g)反应制备HI(g),生成2NA个H-I键6. 以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中错误的是( )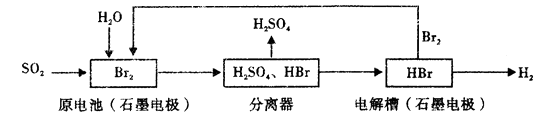 A、该生产工艺中Br2被循环利用 B、在电解过程中,电解槽阴极附近溶液的pH变大 C、原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+ D、该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO47. 下列选项正确的是( )A、25℃时,AgBr在0.01mol/L的MgBr2溶液和NaBr溶液中的溶解度相同 B、NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN) C、25℃时,将0.01mol/L的醋酸溶液加水不断稀释, 减小 D、Na2CO3、NaHCO3溶液等浓度等体积混合后: 3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
A、该生产工艺中Br2被循环利用 B、在电解过程中,电解槽阴极附近溶液的pH变大 C、原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+ D、该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO47. 下列选项正确的是( )A、25℃时,AgBr在0.01mol/L的MgBr2溶液和NaBr溶液中的溶解度相同 B、NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN) C、25℃时,将0.01mol/L的醋酸溶液加水不断稀释, 减小 D、Na2CO3、NaHCO3溶液等浓度等体积混合后: 3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]二、实验题
-
8. 铁及其化合物在生产、生活中有着广泛的应用。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体,同时得到浅绿色酸性溶液。为此,他们设计了如下装置验证所产生的气体(夹持装置省略)并进行有关实验。
 (1)、①若装置A中的试管不加热,则没有明显现象,原因是。
(1)、①若装置A中的试管不加热,则没有明显现象,原因是。②证明有SO2 生成的现象是;为了证明气体中含有氢气,装置B和C中加入的试剂分别为X、CuSO4 , 请写出装置B处反应的化学方程式。
(2)、取装置A试管中的溶液6mL,加入适量氯水恰好反应,再加入过量的KI溶液后,分别取2mL此溶液于3支小试管中进行如下实验:①第一支试管中加入1mLCCl4 , 充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有(填离子符号),由此可以证明该离子与I-发生的氧化还原反应为。
(3)、向盛有H2O2溶液的试管中加入几滴装置A试管中的溶液,溶液变成棕黄色,发生反应的离子方程式为;一段时间后,溶液中有气泡出现并放热,随后有红褐色沉淀生成。产生气泡的原因是;生成沉淀的原因是 (用平衡移动原理解释)。三、综合题
-
9. “绿水青山就是金山银山”,研究NO2、NO、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。(1)、已知: ①NO2+CO CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2
CO
CO2
NO
812kJ
1076kJ
1490kJ
632kJ
②N2(g)+O2(g) 2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g) 2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式 , 该热化学方程式的平衡常数K=(用K1、K2、K3表示)。
(2)、在体积可变的恒压(p总)密闭容器中充入1molCO2 与足量的碳,让其发生反应: C(s)+ CO2(g) 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。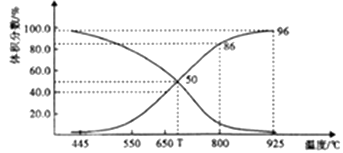
①T℃时,在容器中若充入稀有气体,v(正)v(逆)(填“>”“<”或“="),平衡移动(填“正向”“逆向”或“不”。下同);若充入等体积的CO2 和CO,平衡移动。
②CO体积分数为40%时,CO2 的转化率为。
③已知:气体分压(p分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡Kp常数的表达式为;925℃时,Kp=(用含p总的代数式表示)。
(3)、直接排放含SO2 的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。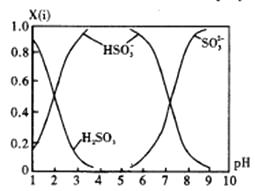
①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因。
10. KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐( 主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题: (1)、请写出镓(与铝同主族的第四周期元素)的原子结构示意图。(2)、为尽量少引入杂质,试剂①应选用(填标号)。理由是。
(1)、请写出镓(与铝同主族的第四周期元素)的原子结构示意图。(2)、为尽量少引入杂质,试剂①应选用(填标号)。理由是。A.HCl溶液
B.H2SO4 溶液
C.氨水
D.NaOH溶液
(3)、沉淀B的化学式为;将少量明矾溶于水,溶液呈弱酸性,其原因是(用离子方程式表示)。(4)、科学研究证明NaAlO2 在水溶液中实际上是Na[Al(OH)4](四羟基合铝酸钠),易拉罐溶解过程中主要反应的化学方程式为。(5)、常温下,等pH的NaAlO2 和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=。(6)、已知室温下,Kw=10×10-14 , Al(OH)3 AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于。11. [化学-选修3:物质结构与性质]铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)、基态K原子核外电子排布简写式为。 K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是 , 各元素的第一电离能由大到小的顺序为。(2)、(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为。(3)、CO能与金属Fe形成Fe(CO)5 , 该化合物熔点为253 K,沸点为为376 K,其固体属于晶体。(4)、下图是金属单质常见的两种堆积方式的晶胞模型。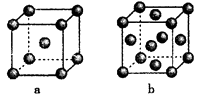
①铁采纳的是a堆积方式.铁原子的配位数为 , 该晶体中原子总体积占晶体体积的比值为(用含π的最简代数式表示)。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为g·cm-3(用含有r、NA的最简代数式表示)。
12. 某新型药物H是一种可用于治疗肿瘤的药物,其合成路线如图所示:
已知:
①E的分子式为C9H8O2 , 能使溴的四氯化碳溶液褪色
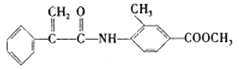
②H的结构简式为
③RCOOH
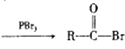 (R为烃基)
(R为烃基)④

请回答下列问题:
(1)、A的苯环上有种不同化学环境的氢原子。(2)、④的反应条件是该反应的类型是;1molH最多可以和mol NaOH 反应。(3)、G的结构简式为。(4)、D在一定条件下可以聚合形成高分子,写出该反应的化学方程式。(5)、E有多种同分异构体,同时满足下列条件的E且含有苯环的同分异构体有种。①能发生银镜反应 ②能发生水解反应 ③分子中含的环只有苯环
(6)、参照H的上述合成路线,设计一条由乙醛和NH2CH(CH3)2 为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线。
-