四川省绵阳市2017-2018学年高三理综-化学三模考试试卷
试卷更新日期:2018-05-08 类型:高考模拟
一、单选题
-
1. 明代名臣于谦作诗“凿开混沌得乌金,藏蓄阳和意最深。爝火燃回春浩浩,洪炉照破夜沉沉……”,诗中所写“乌金”是( )A、焦炭 B、煤炭 C、磁铁矿 D、软锰矿2. NA为阿伏加德罗常数的值,下列说法错误的是( )A、标准状况下3.6 g H2O含有的电子数为2NA B、2.8 g乙烯与聚乙烯的混合物含有的极性键为0.4NA C、0.1 moI Cl2与足量的铁粉充分反应转移的电子数为0.2NA D、1 L 0.2 mol/l的KzCrz07溶液中 的数目为0.2NA3. 近年来,尿素电氧化法处理富含尿素的工业废水和生活污水得到了广泛关注,该法具有操作简易、处理量大、运行周期长等优点,且该过程在碱性条件下产生无毒的CO2、N2.电池工作时,下列说法错误的是( )
 A、负极发生的反应为: B、正极附近溶液的pH增大 C、隔膜只允许阳离子通过 D、处理掉废水中尿素1.0g时消耗O2 0.56L(标准状况)4. 下列操作能达到实验目的的是( )
A、负极发生的反应为: B、正极附近溶液的pH增大 C、隔膜只允许阳离子通过 D、处理掉废水中尿素1.0g时消耗O2 0.56L(标准状况)4. 下列操作能达到实验目的的是( ) A、A B、B C、C D、D5. 香茅醛(结构如图)可作为合成青蒿素的中间体,关丁香茅醛的下列说法错误的是( )
A、A B、B C、C D、D5. 香茅醛(结构如图)可作为合成青蒿素的中间体,关丁香茅醛的下列说法错误的是( ) A、分子式为C10H12O B、分子中所有碳原子可能处于同一平面 C、能使溴水、酸性高锰酸钾溶液褪色 D、1 mol该物质最多与2mol H2发生加成反应6. 下列有关电解质溶液的说法正确的是( )
A、分子式为C10H12O B、分子中所有碳原子可能处于同一平面 C、能使溴水、酸性高锰酸钾溶液褪色 D、1 mol该物质最多与2mol H2发生加成反应6. 下列有关电解质溶液的说法正确的是( )
A、向K2S溶液中加水稀释, 会减小 B、向醋酸溶液中加NaOH至恰好完全反应,水的电离程度先增大后减小 C、向含有MgCO3同体的溶液中加入少量盐酸, 会增大 D、向CuS和FeS的饱和溶液中加入少量Na2S, 保持不变7. 短周期主族元素a、b、c、d原子序数依次增大,b元素的一种同位素可用于考古年代鉴定。甲、乙分别是元素b、d的单质,通常甲为固体,乙为气体,0.001mol/L的丙溶液pH=3;W、X、Y均是由这些元素构成的二元化台物,Y是形成酸雨的主要物质之一。上述物质的转化关系如图,下列说法正确的是( )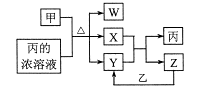 A、原子半径:b B、a、c、d形成的化台物一定是共价化合物 C、W、X、Y中X的熔沸点最高 D、Y、Z均可用排水法收集
A、原子半径:b B、a、c、d形成的化台物一定是共价化合物 C、W、X、Y中X的熔沸点最高 D、Y、Z均可用排水法收集二、综合题
-
8. 二硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行探究。回答下列问题:(1)、在试管中加入少量三硫代碳酸钠样品,加水溶解,所得溶液pH=10,由此可知H2CS3是酸(填“强”或“弱”)。向该溶液中滴加酸性KMnO4溶液,紫色褪去,由此说明Na2CS3具有性。(2)、为了测定某Na2CS3溶液的浓度,按图装置进行实验。将35.0 mLNa2CS3溶液置于下列装置A的三颈瓶中,打开仪器d的活塞,滴入足量2.0 mol/L稀H2SO4 , 关闭活塞。

已知: CS2和H2S均有毒:CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
①仪器d的名称是。反应开始时需要先通入一段时间N2 , 其作用为。
②B中发生反应的离子方程式是。
③反应结束后打开活塞k,再缓慢通入热N2 一段时间,其目的是。
④为了计算三硫代碳酸铀溶液的浓度,可测定B中生成沉淀的质量。称量B中沉淀质量之前需要进行的实验操作名称是 , 若B中生成沉淀的质量为8.4g则35.0 mL三硫代碳酸钠溶液的物质的量浓度是。
⑤若反应结束后将通热N2改为通热空气,通过测定C中溶液质量的增加值来计算三硫代碳酸钠溶液的浓度时,计算值<填“偏高”“偏低”或“无影响”)。
9. 铍作为一种新兴材料日益被重视,有“超级金属…尖端金属…空间金属”之称。工业上常用绿柱石(主要成分3BeO.Al2O3·6SiO2 , 还含有铁等杂质)冶炼铍,一种简化的工艺流程如下:
按元素周期表的对角线规则,Be和Al性质相似;几种金属阳离子的氢氧化物沉淀时的pH如表。回答下列问题:
 (1)、步骤②中将熔块粉碎的目的是;滤渣1的主要成分是。(2)、步骤③加入H2O2时发生反应的离子方程式为 , 从滤液1中得到沉淀的合理pH为(填序号)。
(1)、步骤②中将熔块粉碎的目的是;滤渣1的主要成分是。(2)、步骤③加入H2O2时发生反应的离子方程式为 , 从滤液1中得到沉淀的合理pH为(填序号)。A. 3.3-3.7 B. 3.7—5.0 C. 5.0~5.2 D.5.2—6.5
(3)、步骤④不宜使用NaOH溶液来沉淀Be2+的原因是。从溶液中得到(NH4)2BeF4的实验操作是、过滤、洗涤、干燥。(4)、步骤⑥的反应类型是 , 步骤⑦需要隔绝空气的环境,其原因是。(5)、若绿柱石中Be0的含量为a%,上述过程生产Be的产率为b%,则1t该绿柱石理论上能生产含铍量2%的镀铜合金t。10. 化石燃料开采、加工过程产生的H2S废气可以通过多种方法进行治理.可以制取氢气,同时回收硫单质,既廉价又环保。回答下列问题:(1)、已知:2H2(g)+O2(g)=2H2O(g) △H1S(s)+ O2(g)=SO2(g) △H2
2S(s) S2(g) △H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) △H4
则反应2H2S(g) 2H2(g)+ S2(g)的△H=
(2)、工业上采州高温热分解HzS的方法制取H2 , 在膜反应器中分离出H2。在恒容密闭容器中,阻H2S的起始浓度均为0.009 mol/L控制不同温度进行H2S分解:2H2S(g) 2H2(g)+ S2(g) ,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。

①在935℃时,该反应经过t s H2S的转化率达到P点数值,则在ts内用H2浓度变化表示的平均反应速率v(H2)=。
②温度升高,平衡向方向移动(填“正反应”“逆反应”),平衡常数(填“增大”“减小”或“不变”)。985℃时该反应的平衡常数为。
③随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是。
(3)、电解法治理硫化氢是先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。
①进入电解池的溶液中,溶质是。
②阳极的电极反应式为。
③电解总反应的离子方程式是。
11. [化学选修3:物质结构与性质】翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
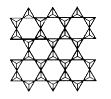
(1)、基态Cr原子的电子排布式为;Fe位于元素周期表的 区。(2)、翡翠中主要成分硅酸锚钠表示为氧化物的化学式为 , 其中四种元素第一电离能由小到大的顺序是。(3)、钙和铁部是第四周期元素,且原子的最外层电子数相同,为什么铁的熔沸点远大于钙?。(4)、在硅酸盐中存在 结构单元,其中Si原子的杂化轨道类型为。当无限多个(用n表示) 分别以3个顶角氧和其他3个 形成层状结构时(如图所示),其中Si、O原子的数目之比为。若其中有一半的Si被Al替换,其化学式为。
 (5)、Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为 , 若Ca与O的核间距离为x nm,则该晶体的密度为 g/cm3。
(5)、Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为 , 若Ca与O的核间距离为x nm,则该晶体的密度为 g/cm3。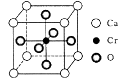 12. [化学一选修5:有机化学基础]
12. [化学一选修5:有机化学基础]聚对苯二甲酸丁二醇酯(PBT)是一种性能优异的热塑性高分子材料。PBT的一种合成路线如图所示:
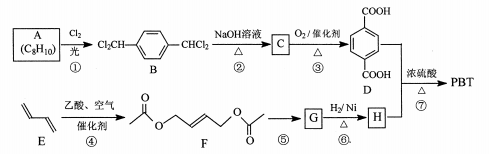
回答下列问题:
(1)、A的结构简式是 , C的化学名称是。(2)、⑤的反应试剂和反应条件分别是。(3)、F的分子式是 , ⑥的反应类型是。(4)、⑦的化学方程式是。(5)、M是H的同分异构体,同时符合_列条件的M可能的结构有种。a.0.1 molM与足量金属钠反应生成氢气2.24 L(标准状况)
b.同一个碳原子上不能连接2个羟基
其中核磁共振氢谱显示3组峰,且峰面积之比为3:1:1的结构简式是。
(6)、以2一甲基-1-3一丁二烯为原料(其它试剂任选),设计制备 的合成路线:
的合成路线: