四川省绵阳市2017-2018学年高三理综-化学二模考试试卷
试卷更新日期:2018-05-08 类型:高考模拟
一、单选题
-
1. 化学与生活、环境密切相关,下列说法错误的是( )A、补铁剂与维生素C共同服用可提高补铁效果 B、铁粉和碳粉的混合物可作食品抗氧化剂 C、生活中钢铁制品生锈主要是析氢腐蚀所致 D、新能源汽车的推广使用有助于减少光化学烟雾2. 下列过程中,气体被氧化的是( )
A、乙烯使酸性KMnO,溶液褪色 B、CO2通入Na2SiO2溶液产生胶状沉淀 C、用湿润的淀粉-KI试纸检验Cl2 D、用CuSO4溶液吸收含H2S的工业废气3. 下表为元素周期表中短周期的一部分,Y元素最高正价与最低负价的代数和为4,下列叙述正确的是( )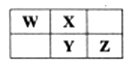 A、原子半径: W B、元素的非金属性:X>Y>Z C、氢化物的热稳定性:W>X D、氧化物对应水化物的酸性: Y4. 利用右图所示装置(必要时可加热)进行下列实验,能得出相应实验结论的是( )
A、原子半径: W B、元素的非金属性:X>Y>Z C、氢化物的热稳定性:W>X D、氧化物对应水化物的酸性: Y4. 利用右图所示装置(必要时可加热)进行下列实验,能得出相应实验结论的是( )选项
甲
乙
丙
实验结论

A
苯、液溴
铁粉
AgNO3溶液
苯与溴发生取代反应
B
浓硫酸
Na2SO3
溴水
SO2具有还原性
C
浓盐酸
KMnO4
品红溶液
Cl2具有漂白性
D
浓氨水
碱石灰
Al2(SO4)3溶液
Al(OH)3具有两性
A、A B、B C、C D、D5. 三蝶烯是最初的“分子马达”的关键组件,三碟烯某衍生物X可用于制备吸附材料,其结构如图所示,3个苯环在空间上互为120°夹角。下列有关X的说法错误的是( )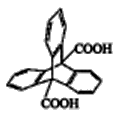 A、分子式为C22H14O4 B、能发生加成、取代反应 C、苯环上的一氯代物有3种 D、分子中最多可能有20个原子位于同一平面上6. 现有的氨合成气,液体燃料合成气制备工艺复杂且能耗高,中科院大连化学物理研究所提出在混合导体透氧膜反应器中一步同时制备氨合成气和液体燃料合成气的概念,并取得研究进展。其工作原理如图所示,下列说法错误的是( )
A、分子式为C22H14O4 B、能发生加成、取代反应 C、苯环上的一氯代物有3种 D、分子中最多可能有20个原子位于同一平面上6. 现有的氨合成气,液体燃料合成气制备工艺复杂且能耗高,中科院大连化学物理研究所提出在混合导体透氧膜反应器中一步同时制备氨合成气和液体燃料合成气的概念,并取得研究进展。其工作原理如图所示,下列说法错误的是( )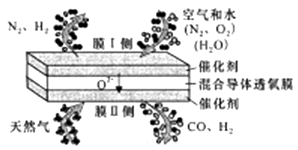 A、膜I侧相当于原电池的正极 B、O2和H2O均发生还原反应 C、膜II侧发生的反应为:CH4+O2--2e-=2H2+CO D、膜II侧消耗CH4与膜I侧生成H2的物质的量之比为1:27. 室温下,浓度均为0.1mol/L.体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH 与 的变化关系如图所示。下列叙述正确的是( )
A、膜I侧相当于原电池的正极 B、O2和H2O均发生还原反应 C、膜II侧发生的反应为:CH4+O2--2e-=2H2+CO D、膜II侧消耗CH4与膜I侧生成H2的物质的量之比为1:27. 室温下,浓度均为0.1mol/L.体积均为V0的NaX、NaY溶液分别加水稀释至体积V。已知pOH=-lgc(OH-),pOH 与 的变化关系如图所示。下列叙述正确的是( )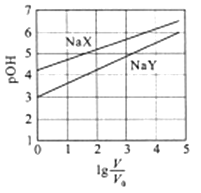 A、HX、HY都是弱酸,且Ka(HX)>Ka(HY) B、图中pOH随 变化始终满足直线关系 C、 =3时,NaX溶液中所含离子总数小于NaY溶液 D、分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)
A、HX、HY都是弱酸,且Ka(HX)>Ka(HY) B、图中pOH随 变化始终满足直线关系 C、 =3时,NaX溶液中所含离子总数小于NaY溶液 D、分别向稀释前的两种溶液加盐酸至pH=7时,c(X-)=c(Y-)二、填空题
-
8. 三氯氧磷(POCl3)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3 , 实验装置设计如下:
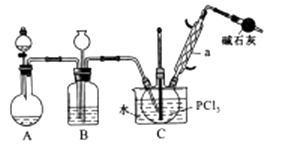
有关物质的部分性质如下表:
熔点/℃
沸点/℃
其他
PCl3
-112
75.5
遇水生成H3PO3和HCl,遇O2生成POCl3
POCl3
2
105.3
遇水生成H3PO4和HCl,能溶于PCl3
回答下列问题:
(1)、仪器a的名称是 , 装置A中发生反应的化学方程式为。(2)、B装置的作用除观察O2的流速之外。还有。(3)、C装置控制反应在60℃~65℃进行,其主要目的是。(4)、通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L的AgNO3溶液 40.00 mL,使 Cl-完全沉淀。
III.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10 , Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是(填标号),滴定终点的现象为。
a.FeCl2
b.NH4Fe(SO4)2
c.淀粉
d.甲基橙
②Cl元素的质量百分含量为(列出算式)。
③步骤III加入硝基苯的目的是 , 如无此操作,所测Cl元素含量将会(填“偏大”“偏小”或“不变”)。
9. 目前,我国是最大的钢铁生产国,钢铁是国民经济的基础产业,铁及其化合物的应用也越来越广泛。回答下列问题:(1)、画出铁的原子结构示意图:。(2)、工业炼铁时常用CO还原铁矿粉,已知:① Fe2O3(s) + 3CO(g)=2Fe(s)+ 3CO2(g) △H=-24.8 kJ/mol
② Fe3O4(S)+CO(g)=-3FeO(g)+CO2(g) △H= +19.4 kJ/mol
③ FeO(s)+CO(g)=Fe(s)+CO2(g) △H= -11.0 kJ/mol
则反应3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)的△H= 。
(3)、Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) 反应温度与K的关系如下表:反应温度/℃
1000
1150
1300
平衡常数K
64
50.7
42.9
恒温1000℃在体积为10L的恒容密闭容器中加入0.1molFe2O3和0.1molCO,气体混合物中CO2的体积分数φ(CO2)随时间t的变化关系如图所示。
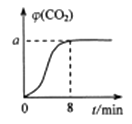
①前 8minCO 的反应速率为;平衡时a=。
②若再向平衡混合物中加入0.01molCO 和0.02molCO2 , 平衡移动;若要使平衡混合气中CO2的体积分数增大,下列措施可行的是(填标号)。
A.增大Fe2O3用量
B.增大压强
C.降低温度
D.向容器中再充入少量CO
(4)、纳米级的Fe3O4在催化剂、造影成像、药物载体、靶向给药等领域都有很好的应用前景,工业生产中常用“共沉淀法”来制备。将FeCl2和FeCl3按一定比例配成混合溶液,用NaOH溶液作为沉淀剂,在特定条件下即可制得纳米级的Fe3O4 , 反应的离子方程式是 , 在实际生产中Fe2+和Fe3+反应用量比常是2:3,甚至1:1,为什么?。(5)、纳米铁粉可用于除去废水中的NO3- , 反应的离子方程式为:4Fe+ NO3-+ 10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是;若加入少量Cu2+ , 废水中NO3-的去除速率大大加快,可能的原因是。10. 钴酸锂电池应用广泛,电池正极材料主要含有LiCoO2、导电剂乙炔黑、铝箔及少量Fe,可通过下列实验方法回收钴、锂。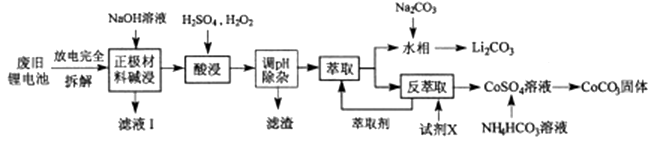
几种金属离子沉淀完全(离子浓度为10-5mo/L) 的pH如下表:
离子
Fe3+
Al3+
Fe2+
Co2+
溶液pH
3.2
4.7
9.0
9.2
回答下列问题:
(1)、LiCoO2中,Co元素的化合价为 , 滤液I的主要成分是。(2)、已知:氧化性Co3+>H2O2>Fe3+ , “酸浸”过程中H2O2所起主要作用是。“调节pH”除去的离子主要有Al3+和。(3)、酸浸时浸出率随温度变化如图所示,温度升高至50℃以上时漫出率下降的原因是。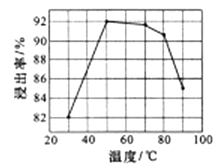 (4)、“萃取”和“反萃取“可简单表示为: Co2++2(HA)2 Co(HA2)2+2H+。则反萃取过程加入的试剂X是。(5)、向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为。(6)、工业上用Li2CO3粗品制备高纯Li2CO3可采用如下方法:将Li2CO3溶于盐酸,加入如图所示的电解槽,电解后向LiOH溶液中加入稍过量的NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
(4)、“萃取”和“反萃取“可简单表示为: Co2++2(HA)2 Co(HA2)2+2H+。则反萃取过程加入的试剂X是。(5)、向CoSO4溶液中加入NH4HCO3溶液,发生反应的离子方程式为。(6)、工业上用Li2CO3粗品制备高纯Li2CO3可采用如下方法:将Li2CO3溶于盐酸,加入如图所示的电解槽,电解后向LiOH溶液中加入稍过量的NH4HCO3溶液,过滤、烘干得高纯Li2CO3。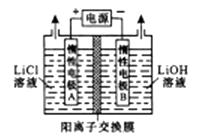
①电解槽中阳极的电极反应式是。
②向LiOH溶液中加入稍过量的NH4HCO3溶液时,发生反应的化学方程式为。
11. 氮及其化合物与人类生产、生活息息相关。其中尿素(H2NCONH2) 是人类最早合成的有机物,工业上生产尿素的反应为: N2+3H2 2NH3 , 2NH3+CO2 H2NCONH2+H2O。回答下列问题:(1)、纳米氧化铜、纳米氧化锌均可作合成氨的催化剂,Cu2+价层电子的轨道表达式为 , Zn位于元素周期表的区。(2)、C、N、O三种元素第一电离能从大到小的顺序是。(3)、上述化学方程式中的无机化合物,沸点由高到低的顺序是 , 原因: 。(4)、尿素分子中,原子杂化轨道类型有 , σ键与π键数目之比为。(5)、氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1) 和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。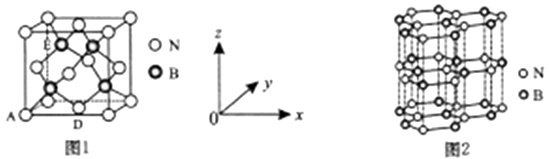
①晶胞中的原子坐标参数可表亓晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为( ),则E原子的坐标参数为。X-射线衍射实验测得立方氮化硼晶胞参数为361.5pm,则立方氮化硼晶体N 与B的原子半径之和为pm。( )
②已知六方氮化硼同层中B-N距离为acm,密度为dg/cm3 , 则层与层之间距离的计算表达式为pm。
12. 化合物F是一种有机光电材料中间体,由A制备F的一种合成路线如下: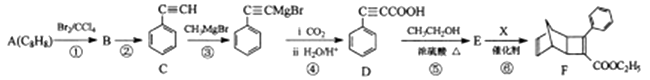
已知:
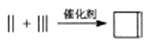
回答下列问题:
(1)、A的结构简式为 , C的化学名称是。(2)、①、③的反应类型分别是、。(3)、②的反应条件是 , 有机物X的结构简式为。(4)、反应⑤的化学方程式为。(5)、芳香化合物H是D的同分异构体,满足下列条件的同分异构体共有种;a.能发生银镜反应
b.含 有—C≡CH 结 构
c.无—C≡C—O—结构
写出其中核磁共振氢谱峰面积比为1:2:2:1的一种有机物的结构简式。
(6)、写出由1-丁炔和乙炔为原料制取化合物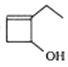 的合成略线(其他试剂任选)。
的合成略线(其他试剂任选)。