四川省乐山市2017-2018学年高三理综-化学二模考试试卷
试卷更新日期:2018-05-08 类型:高考模拟
一、单选题
-
1. 2017世界环境日中国主题:“绿水青山就是金山银山。”倡导保护自然,践行绿色生活,共同建设美丽中国。下列做法应提倡的是( )A、积极开发太阳能等新能源汽车 B、推广使用一次性塑料袋和纸巾 C、工业污水直接用于农田的灌溉 D、大量生产防霾口罩以治理PM2.52. 乳酸薄荷酯简称ML,可添加到牙膏、口香糖、饮料等中,有长效的清凉效果,其结构简式如下图所示。下列说法正确的是( )
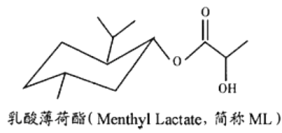 A、ML的分子式为:Cl3H28O3 B、1mol ML完全水解能消耗2mol NaOH C、ML发生消去反应的产物只有一种结构 D、ML分子中的所有碳原子在同一平面上3. 下列实验能达到实验目的,且操作规范的是( )
A、ML的分子式为:Cl3H28O3 B、1mol ML完全水解能消耗2mol NaOH C、ML发生消去反应的产物只有一种结构 D、ML分子中的所有碳原子在同一平面上3. 下列实验能达到实验目的,且操作规范的是( )实验目的
实验操作、现象
A
除去NaHCO3固体中的Na2CO3
将混合物装入试管中,用酒精灯加热至恒重
B
量取20.00mL0.1mol/LKMnO4溶液
在25mL碱式滴定管中装入KMnO4溶液,调整初始读数为5.00mL后,将剩余KMnO4溶液放入锥形瓶中
C
证明镁与CO2发生了置换反应
用坩埚钳将点燃的镁条置于盛有CO2的集气瓶中,瓶内壁有黑色固体生成
D
判断某溶液中有Na+ , 并且没有K+
用洁净的铂丝蘸取溶液在酒精灯的外焰上灼烧,观察到火焰呈黄色
A、A B、B C、C D、D4. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、2.7g 铝中加入1mol/L NaOH溶液,转移的电子数是0.3NA B、0.05mol LiCH3中所含有的电子数为0.6NA C、1mol石墨烯(单层石墨)的六元环数为0.6NA D、0.1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和是0.2NA5. 下图为元素周期表短周期的一部分,乙原子的电子层数为n,最外层电子数为2n+1。下列叙述错误的是( ) A、氢和R、W三种元素形成的阴离子有3种以上 B、RY2分子中每个原子的最外层均为8电子结构 C、R、Y、Z的最高价氧化物对应水化物的酸性依次增强 D、X、Z的氢化物的热稳定性和还原性,都依次减弱6. 据报道,用甲酸提供氢气的燃料电池由瑞士科技工作者开发成功。燃料电池包括两个部分:甲(HYFORM)中使用钌(Ru)基催化剂从甲酸中产生氢气;乙(PEMFC)是以NaOH为电解质的氢氧燃料电池。装置的原理示意图如下。下列有关说法错误的是( )
A、氢和R、W三种元素形成的阴离子有3种以上 B、RY2分子中每个原子的最外层均为8电子结构 C、R、Y、Z的最高价氧化物对应水化物的酸性依次增强 D、X、Z的氢化物的热稳定性和还原性,都依次减弱6. 据报道,用甲酸提供氢气的燃料电池由瑞士科技工作者开发成功。燃料电池包括两个部分:甲(HYFORM)中使用钌(Ru)基催化剂从甲酸中产生氢气;乙(PEMFC)是以NaOH为电解质的氢氧燃料电池。装置的原理示意图如下。下列有关说法错误的是( )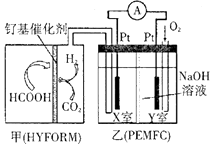 A、该燃料电池使用的甲酸比氢气更易储存和运输 B、Y室的电极反应式:O2+4H++4e-=2H2O C、X室为负极室,Y室为正极室 D、甲中消耗1mol甲酸,乙中转移2mol电子7. 在某温度时将a mol/L 氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是( )
A、该燃料电池使用的甲酸比氢气更易储存和运输 B、Y室的电极反应式:O2+4H++4e-=2H2O C、X室为负极室,Y室为正极室 D、甲中消耗1mol甲酸,乙中转移2mol电子7. 在某温度时将a mol/L 氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法正确的是( )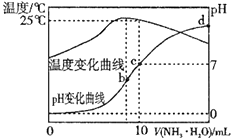 A、a<1.0 B、水的电离程度:b<d<c C、C点:c(NH4+)=1.0mol/L D、d点:c(Cl-)<c(NH4+)
A、a<1.0 B、水的电离程度:b<d<c C、C点:c(NH4+)=1.0mol/L D、d点:c(Cl-)<c(NH4+)二、综合题
-
8. 莫尔盐[(NH4)2Fe(SO4)2·6H2O](浅绿色)常用作化学试剂、医药以及用于冶金、电镀等。某课题组通过实验来探究莫尔盐晶体加热时的分解产物,回答下列问题:(1)、甲同学提出猜想;分解产物可能是N2、Fe2O3、SO3、H2O四种物质。你是否同意并说明理由。(2)、乙同学设计了如图装置:

①其中A装置中的固体变为红棕色,则固体产物中含有;C装置中红色褪去,说明气体产物中含有。
②为验证A中残留物是否含有FeO,需要选的试剂有。
A.KSCN溶液
B.浓盐酸
C.KMnO4溶液
D.稀硫酸
(3)、丙同学想利用乙同学的装置证明分解产物中含有氨气,只需更换B、C 中的试剂即可,则更换后的试剂B为 , C为。(4)、丁同学认为莫尔盐晶体分解的气体产物中含有SO3(g)、SO2(g)及N2。为了进行验证,丁同学选用乙同学的A装置和下图装置组装后进行实验。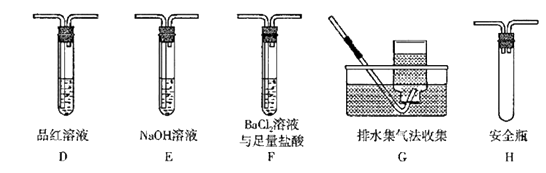
①丁同学的实验中,装置依次连接的合理顺序为A、。
②装置F中,足量盐酸的作用是。
9. C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。(1)、已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJ/molS(l)+O2(g)=SO2(g) ΔH2=-296kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式。
(2)、一定温度下,向2L恒容密闭容器中通入2molCO和1molSO2 , 发生上述(1)中回收硫的反应。若反应进行到20min时达平衡,测得CO2的体积分数为0.5,则前20min的反应速率ν(CO)= , 该温度下反应化学平衡常数K=(L·mol-1)(3)、在不同条件下,向2L恒容密闭容器中通入2molCO和1molSO2 , 反应体系总压强随时间的变化如图(Ⅰ)所示: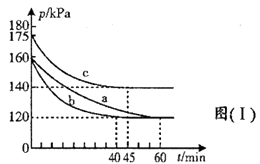
①图(Ⅰ)中三组实验从反应开始至达到平衡时,v(CO)最大的为(填序号)
②与实验a相比,c组改变的实验条件可能是。
(4)、“亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图(Ⅱ)所示,b点时溶液pH=7,则n(NH4+)∶n(HSO3-)=。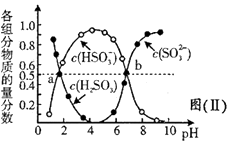 (5)、间接电化学法可除NO。其原理如图(Ⅲ)所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性)。
(5)、间接电化学法可除NO。其原理如图(Ⅲ)所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性)。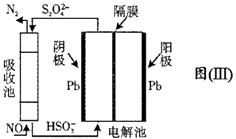 10. 三盐基硫酸铅(3PbO·PbSO4·H2O,相对分子质量为990)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。
10. 三盐基硫酸铅(3PbO·PbSO4·H2O,相对分子质量为990)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。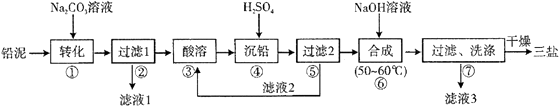
已知:Ksp(PbSO4)=1.82×10-8 , Ksp(PbCO3)=1.46×10-13;(2)铅与冷盐酸、冷硫酸几乎不起作用。请回答下列问题:
(1)、写出步骤①“转化”的化学方程式 , 该反应能发生的原因是。(2)、步骤②“过滤1”后所得滤渣的主要成分为。(3)、步骤③“酸溶”,最适合选用的酸为 , 为提高酸溶速率,可采取的措施是(任意写出一条)。(4)、若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1 , 则此时c(SO42-)= mol·L-1。(5)、从原子利用率的角度分析该流程的优点为。(6)、步骤⑥“合成”三盐的化学方程式为。若得到纯净干燥的三盐49.5t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为%(结果保留一位小数)11. 【化学——选修3:物质结构与性质】2017年4月26日,海军成立68周年时,我国第一艘国产航母成功下水。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。(1)、镍铬钢抗腐蚀性能强,Ni2+最高能级电子的运动状态有种,铬元素在周期表中区。(2)、航母甲板涂有一层耐高温的材料聚硅氧烷(结构如图所示),其中C原子杂化方式为杂化。 (3)、海洋是元素的摇篮,海水中含有大量卤族元素。
(3)、海洋是元素的摇篮,海水中含有大量卤族元素。①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是(填元素符号)
氟
氯
溴
碘
第一电离能(kJ/mol)
1681
1251
1140
1008
②根据价层电子对互斥理论,预测ClO3-的空间构型为形,写出一个ClO3-的等电子体的化学符号。
③已知高碘酸有两种形式,化学式分别为H5IO6(
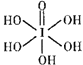 )和HIO4 , 前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6HIO4(填“>”“<”或“= ”)(4)、海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+ , 白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为。已知该晶体的密度为ρg·cm-3 , 阿伏加德罗常数为NA , 该晶体中Zn2+和S2-原子之间的最短距离为体对角线的1/4,则该晶体中S2-和Zn2+之间的最短距离为pm。(写出计算式即可)
)和HIO4 , 前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6HIO4(填“>”“<”或“= ”)(4)、海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶体结构如图所示(黑球表示Zn2+ , 白球表示S2-)。则该晶体中与Zn2+等距且最近的S2-形成的立体图形为。已知该晶体的密度为ρg·cm-3 , 阿伏加德罗常数为NA , 该晶体中Zn2+和S2-原子之间的最短距离为体对角线的1/4,则该晶体中S2-和Zn2+之间的最短距离为pm。(写出计算式即可)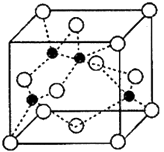 12. 【化学——选修5:有机化学基础】有机化合物甲有镇咳、镇静的功效,其合成路线如下:
12. 【化学——选修5:有机化学基础】有机化合物甲有镇咳、镇静的功效,其合成路线如下: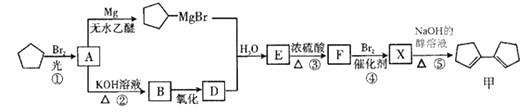
已知:
 (R、R'、R"代表烃基或氢)(1)、有机物甲的分子式为 , 有机物A中含有的官能团的名称为。(2)、有机物B的名称是 , 由B→D 所需的反应试剂和反应条件为。(3)、在上述①~⑤反应中,属于取代反应的有(填序号)。(4)、写出E→F的化学方程式。(5)、写出同时满足下列条件的甲的同分异构体的结构简式。
(R、R'、R"代表烃基或氢)(1)、有机物甲的分子式为 , 有机物A中含有的官能团的名称为。(2)、有机物B的名称是 , 由B→D 所需的反应试剂和反应条件为。(3)、在上述①~⑤反应中,属于取代反应的有(填序号)。(4)、写出E→F的化学方程式。(5)、写出同时满足下列条件的甲的同分异构体的结构简式。(Ⅰ)属于芳香族化合物 (Ⅱ)核磁共振氢谱上只有2组峰
(6)、根据题给信息,写出以CH4为原料制备CH3CHO的合成路线(其他试剂任选)。