四川省广安、眉山、内江、遂宁2017-2018学年高三理综-化学二模考试试卷
试卷更新日期:2018-05-08 类型:高考模拟
一、单选题
-
1. 下列对生活中常见物质成分的分析错误的是( )
 A、A B、B C、C D、D2. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、1mol羟基(-OH)与17gNH3所含电子数都为NA B、50mL12mol/L盐酸与过量MnO2反应转移的电子数为0.3NA C、标准状况下,2.24LHF中含有的分子数为0.1NA D、25℃时,1LpH=1的H2SO4溶液中含有H+的数目为0.1NA3. 苯乙烯转化为乙苯的反应为
A、A B、B C、C D、D2. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、1mol羟基(-OH)与17gNH3所含电子数都为NA B、50mL12mol/L盐酸与过量MnO2反应转移的电子数为0.3NA C、标准状况下,2.24LHF中含有的分子数为0.1NA D、25℃时,1LpH=1的H2SO4溶液中含有H+的数目为0.1NA3. 苯乙烯转化为乙苯的反应为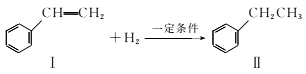 ,下列相关分析正确的是( )
,下列相关分析正确的是( )
A、I一Ⅱ属于取代反应 B、可用CCl4分离I和Ⅱ的混合物 C、I和Ⅱ都属于苯的同系物 D、可以用溴水鉴别I和Ⅱ4. 短周期主族元素R、T、Q在周期表中的相对位置如图所示;在常温暗处,R元素的单质可与氢气剧烈化合并爆炸。下列说法正确的是( ) A、原子半径:Q>T>R B、最高价氧化物对应水化物的酸性:R>Q>T C、TR5水解生成两种酸 D、Q2和Q8的相互转化是物理变化5. 完成下列实验目的,相关实验设计正确的是( )A、氨气喷泉实验
A、原子半径:Q>T>R B、最高价氧化物对应水化物的酸性:R>Q>T C、TR5水解生成两种酸 D、Q2和Q8的相互转化是物理变化5. 完成下列实验目的,相关实验设计正确的是( )A、氨气喷泉实验 B、比较AgCl和Ag2S的Ksp大小
B、比较AgCl和Ag2S的Ksp大小  C、实验室制备CO2待用
C、实验室制备CO2待用  D、测定盐酸浓度
D、测定盐酸浓度  6. 中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是( )
6. 中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是( )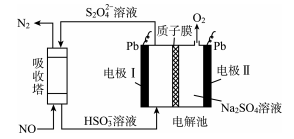 A、电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2 B、电解池中质子从电极I向电极Ⅱ作定向移动 C、吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3- D、每处理1 mol NO电解池质量减少16g7. 常温下,分别向体积相同、浓度均为1 mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lg C)间的关系如图。下列对该过程相关分析正确的是( )
A、电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2 B、电解池中质子从电极I向电极Ⅱ作定向移动 C、吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3- D、每处理1 mol NO电解池质量减少16g7. 常温下,分别向体积相同、浓度均为1 mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lg C)间的关系如图。下列对该过程相关分析正确的是( )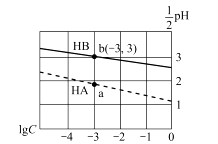 A、HB的电离常数(KA)数量级为10-3 B、其钠盐的水解常数(Kh)大小关系是:NaB>NaA C、a、b两点溶液中,水的电离程度b<a D、当lg C= -7时,两种酸溶液均有pH=7
A、HB的电离常数(KA)数量级为10-3 B、其钠盐的水解常数(Kh)大小关系是:NaB>NaA C、a、b两点溶液中,水的电离程度b<a D、当lg C= -7时,两种酸溶液均有pH=7二、综合题
-
8. 我国盛产黄铜矿(主要含CuFeS2及少量Fe2O3、SiO2),以黄铜矿为原料生产碱式氯化铜的工业流程如下。
已知:I.a、b、c均为整数 II.
(1)、CuFeS2中S的化合价为。(2)、实验测得反应I中有SO42-生成,该反应中氧化剂与还原剂的物质的量之比为 ;H2O2优于HNO3的原因是。(3)、在调节pH时,为稳定浸出液的pH,需要用NH3·H2O- NH4Cl为缓冲溶液。已知 25℃时,向0.02mol/L的氨水中缓慢加入等浓度的NH4 Cl溶液,该过程中 (填“变大”、“变小”或“不变”);若最后所得溶液呈中性,则该体系中离子浓度的大小顺序是。(4)、操作I和操作Ⅱ与生活中的下列操作____具有相似的化学原理。A、用淘米筛沥水 B、泡茶 C、海水晒盐 D、用漏斗分装液体 E、煎药(5)、反应Ⅱ中NaCl浓度过大,碱式氯化铜产率较低,其原因是。(6)、为测定制得的碱式氯化铜的组成,某实验小组进行下列实验:称取一定量的碱式氯化铜,用少量稀HNCl溶解后配成100. 00 mL溶液A;取25. 00 mL溶液A,加入足量AgNO。溶液,得到AgCl(M一143.5g/mol)固体1.435 g;另取25. 00 mL.溶液A,用浓度为0.40 mol/L的Na2H2Y标准溶液滴定Cu2+(Cu2++H2Y2-=CuY2-+2H+),终点时,消耗标液50. 00 mL。则该碱式氯化铜的化学式为;反应Ⅲ的化学反应方程式为9. 2017年5月,中国对“可燃冰”试采成功。“可燃冰”是天然气水合物,被称为未来新能源。回答下列问题:(1)、用Cu2Al2O4作催化剂制备乙酸已知: ,各物质相对能量大小如图。
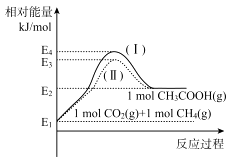
①a=。
②反应物的活化分子浓度大小:过程I 过程Ⅱ(填“大于”、“小于”或“等于”)。
(2)、甲烷超干催化重整(DRM)制备CO,在Ni、CaO及Fe3O4的共同催化作用下,可以获得极高浓度的CO,其机理如下:第①步:Ni基催化
第②步:Fe的还原
第③步:CO2的捕获
第④步:CO2的释放与还原
设计第②步与第③步反应有利于实现氢物种与的彻底分离,从勒夏特列原理的角度看,这也有利于;过程①中,当投料比 = 时,才能保持催化剂组成不变。
(3)、甲烷催化重整与压强的关系已知: ,现有温度相同的I、Ⅱ、Ⅲ三个恒压密闭容器,均已充入1 mol CH4(g)和1 mol CO2 (g),三个容器的反应压强分别为P1 atm、P2 atm、P3 atm,在其他条件相同的情况下,反应均进行到t min时,CO2)的平衡体积分数φ(CO2)如下左图,此时I、Ⅱ、Ⅲ三个容器中一定处于化学平衡状态的是 (填容器号);求该温度条件下反应的平衡常数Kp= (计算表达式)。【已知:Kp是用分压力代替各物质的浓度计算的平衡常数,任一组分B的分压p(B)等于总压p乘以它的体积分数y(B)】
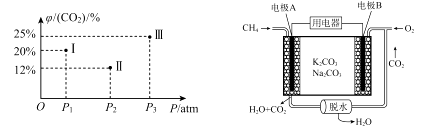 (4)、甲烷用于燃料电池
(4)、甲烷用于燃料电池已知:甲烷电池的工作原理如上有图,则负极反应方程式为 ;当A极消耗标况下44.8 LCH4时,理论上B极转移电子的物质的量为 mol。
10. 1-溴丁烷可用作稀有元素萃取剂。实验室制取1-溴丁烷的原理如下: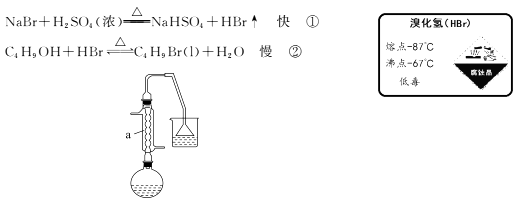
【产品制备】
如图,在125 mL烧瓶中加入10 mL水,然后加入12 mL(0.22 mol)浓硫酸,摇匀冷却至室温,再加入7.5 mL(0. 08 mol)正丁醇,混合后加入10.3 g(0. 10 mol)溴化钠晶体,充分振荡,加入几粒沸石,在石棉网上用小火加热烧瓶并回流半小时。
(1)、仪器a的名称为 , 用恰当的化学原理解释能发生反应①的原因是。(2)、烧杯中所用试剂为水,其主要目的是吸收 (填化学式);(3)、制备过程中烧瓶中溶液逐渐出现浅黄色,为此,有人提出用浓H3PO4代替浓H2SO4 , 其理由是。(4)、【初步提纯】已知:醇类可与浓硫酸作用生成烊盐溶于浓硫酸中(烊盐难溶于有机溶剂)。
步骤①:加热蒸馏出烧瓶中所有的溴丁烷粗品。
步骤②:将粗品用5mL浓硫酸洗涤。
步骤③:将步骤②中有机层依次分别用水、饱和碳酸氢钠溶液和水各10 mL洗涤。
步骤④:将步骤③有机物移入蒸馏烧瓶中,加热蒸馏,得到产品6. 85 g。
步骤①的目的是分离出产品中的无机物,判断溴丁烷是否完全蒸馏出来的方法是:用一支试管收集几滴馏出液,向其中加入少许水并摇动,如果表明溴丁烷已经被 完全蒸馏出来。
(5)、步骤②用5mL浓硫酸洗涤的目的是除去 ;第一次水洗可以除去大部分硫酸,第二次水洗的目的是。(6)、实验的产率为(M(C4H9Br) =137 g/mol);制备过程中,有利于提高产品产率的措施有适当延长回流时间及(选填字母)。A.回流时适时搅拌溶液
B.将块状NaBr研细使用
C.将正丁醇分次加入
D.对正丁醇进行干燥处理
11. 含钴化合物在机械制造、磁性材料等领域具有广泛的应用,请回答下列问题:(1)、基态Co3+的价电子排布图为。(2)、钴的配合物[Co(NH3)5Br](NO3)2①第一电离能NO(填“大于”、“小于”或“不能确定”);两种配位原子的杂化轨道类型均为;
②钴离子周围配位键数目(配位数)是 ;NO3-的空间构型为;
③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是。
(3)、某钴氧化物品体具有CoO2的层状结构如下图所示(小球表示Co,大球表示O)。下列用粗线面出的结构单元不能描述CoO2)的化学组成的是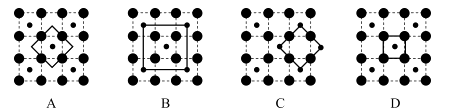 (4)、Co的另一种氧化物的晶胞如图,已知钴原子的半径为apm,氧原子的半径为b pm,它们在晶体中是紧密接触的,钴原子填在氧原子的 填“正八面体”、“正四面体”或“立方体”)空隙;钴原子与跟它次近邻的氧原子之间的距离为;在该钴的氧化物品体中原子的空间利用率为(均用含a、b的计算表达式表示)。
(4)、Co的另一种氧化物的晶胞如图,已知钴原子的半径为apm,氧原子的半径为b pm,它们在晶体中是紧密接触的,钴原子填在氧原子的 填“正八面体”、“正四面体”或“立方体”)空隙;钴原子与跟它次近邻的氧原子之间的距离为;在该钴的氧化物品体中原子的空间利用率为(均用含a、b的计算表达式表示)。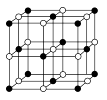 12. 合成神经抑制剂F的一种路线如图所示:
12. 合成神经抑制剂F的一种路线如图所示: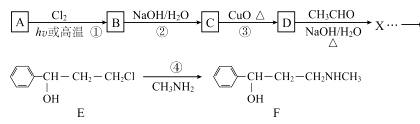
已知:
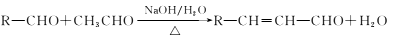
请回答下列问题:
(1)、已知芳香烃A的相对分子质量为92,A的结构简式为;B的系统命名是 ;C中含氧官能团的名称是。(2)、反应③的化学反应方程式为;①~④中属于取代反应的是。(3)、D分子中最多有个原子共平面。(4)、④的反应中,因反应温度控制不当,常常有副产物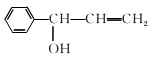 生成,写出可能的副反应方程式。 (5)、包含C在内,C的同分异构体中芳香族化合物共有种,其中满足下列条件同分异构体的结构简式为。
生成,写出可能的副反应方程式。 (5)、包含C在内,C的同分异构体中芳香族化合物共有种,其中满足下列条件同分异构体的结构简式为。①能使FeCl3溶液显色,②核磁共振氢谱上有4组峰,且峰面积之比为3:2:2:1。
(6)、已知-CHO与RNH2易发生反应,现以中间体X为原料,设计出制备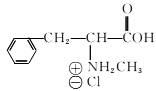 的合成路线(无机试剂自选):
的合成路线(无机试剂自选):流程示例:
