四川省成都市2017-2018学年高三理综-化学一模考试试卷
试卷更新日期:2018-05-08 类型:高考模拟
一、单选题
-
1. 下列物质的化学性质及在生活中的相关应用均正确的是( )A、液氯具有强氧化性,常用作环境消毒剂 B、苏打具有碱性,常用于中和人体过多胃酸 C、铝箔具有还原性,可作为脱氧剂用于药品包装材料 D、烹鱼时加入料酒发生氧化反应,可去腥提香2. 下列分析正确的是( )A、异丁烷的二氯代物有4种 B、区别蛋白质和淀粉可用浓硝酸做颜色反应 C、石蜡油分解产物均能使酸性KMnO4溶液褪色 D、甲苯的硝化反应方程式为:
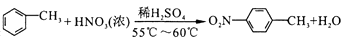 3. 设NA为阿伏加德罗常数的值,下列叙述一定正确的是( )A、2.0gH218O和D2O的混合物中含有质子数为NA B、1.0L2.0mol/LNaOH溶液中含有氧原子数为2NA C、3.4gH2O2参加氧化还原反应时转移电子数为0.1 NA D、标准状况下2.24L的CCl4含有共价键数目为0.4 NA4. W、X、Y、Z是原子序数依次增大的四种短周期主族元素。其中X、Y为金属元素,W和Z同主族。Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。下列说法不一定正确的是( )A、原子半径:X>Y>Z>W B、Y位于第三周期第ⅢA族 C、W和X组成的化合物为碱性氧化物 D、向W、X、Y组成的化合物水溶液中滴入稀盐酸至过量,溶液先变浑浊后澄清5. 下列实验过程中的相关步骤正确的是( )
3. 设NA为阿伏加德罗常数的值,下列叙述一定正确的是( )A、2.0gH218O和D2O的混合物中含有质子数为NA B、1.0L2.0mol/LNaOH溶液中含有氧原子数为2NA C、3.4gH2O2参加氧化还原反应时转移电子数为0.1 NA D、标准状况下2.24L的CCl4含有共价键数目为0.4 NA4. W、X、Y、Z是原子序数依次增大的四种短周期主族元素。其中X、Y为金属元素,W和Z同主族。Z的核外电子数是W的2倍,W和Z的质子数之和等于X和Y的质子数之和。下列说法不一定正确的是( )A、原子半径:X>Y>Z>W B、Y位于第三周期第ⅢA族 C、W和X组成的化合物为碱性氧化物 D、向W、X、Y组成的化合物水溶液中滴入稀盐酸至过量,溶液先变浑浊后澄清5. 下列实验过程中的相关步骤正确的是( )选项
实验
操作
A
检验Fe(NO3)2晶体是否变质
将样品溶于稀硫酸,滴入几滴KSCN溶液
B
验证Mg(OH)2 和Fe(OH)3的Ksp大小
取2mL 1.0mol/L NaOH 溶液,先滴3 滴1.0mol /L MgCl2溶液,再滴3 滴1.0mol/L FeCl3溶液
C
比较醋酸和碳酸酸性强弱
pH 计分别伸入0.1mol/L CH3COONa 溶液和0.1mol/LNa2CO3溶液中,读取pH
D
测定中和反应反应热
混合前分别用冲洗干净的温度计测量50mL0.50mol/L HCl溶液与50mL 0.55mol/L NaOH 溶液的温度
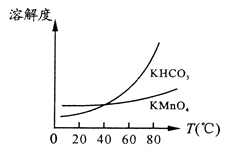
A、A B、B C、C D、D6. 摩拜单车利用车篮处的太阳能电池板向智能锁中的锂离子电池充电,电池反应原理为:LiCoO2+6C Li1-xCoO2+LixC6。示意图如右。下列说法正确的是( ) A、充电时,阳极的电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2 B、该装置工作时涉及到的能量形式有3种 C、充电时锂离子由右向左移动 D、放电时,正极质量增加7. 常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知 =0.58)。下列分析错误的是( )
A、充电时,阳极的电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2 B、该装置工作时涉及到的能量形式有3种 C、充电时锂离子由右向左移动 D、放电时,正极质量增加7. 常温时,若Ca(OH)2和CaWO4(钨酸钙)的沉淀溶解平衡曲线如图所示(已知 =0.58)。下列分析错误的是( ) A、a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态 B、饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-) C、饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊 D、石灰乳与0.1mol/LNa2WO4溶液混合后发生反应:Ca(OH)2+WO42-=CaWO4+2OH-
A、a点表示Ca(OH)2与CaWO4均未达到溶解平衡状态 B、饱和Ca(OH)2溶液和饱和CaWO4溶液等体积混合: c(OH-)>c(H+)>c(Ca2+)>c(WO42-) C、饱和Ca(OH)2溶液中加入少量Na2O,溶液变浑浊 D、石灰乳与0.1mol/LNa2WO4溶液混合后发生反应:Ca(OH)2+WO42-=CaWO4+2OH-二、实验题
-
8. 某化学小组欲进行如下实验探究金属与浓硫酸反应。试回答下列问题。
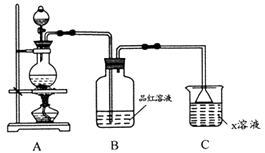 (1)、利用上图装置研究铜与浓硫酸反应,反应化学方程式为;B装置的目的是;x溶液为。(2)、将上述实验中的铜改为黄铜(铜锌合金),实验后阶段可观察到倒立漏斗边缘有气体冒出,且越来越快。该气体可能为 , 气体产生越来越快的原因可能是(至少两点)。验证该气体的实验方案如下:
(1)、利用上图装置研究铜与浓硫酸反应,反应化学方程式为;B装置的目的是;x溶液为。(2)、将上述实验中的铜改为黄铜(铜锌合金),实验后阶段可观察到倒立漏斗边缘有气体冒出,且越来越快。该气体可能为 , 气体产生越来越快的原因可能是(至少两点)。验证该气体的实验方案如下: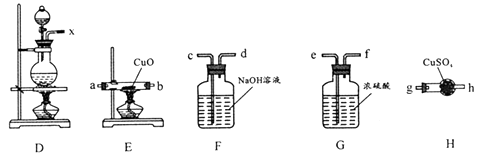
①装置连接顺序:x→;
②能证明上述假设成立的实验现象是。
(3)、取少量镁粉加入盛浓硫酸的烧杯,在通风橱中实验。充分反应后溶液中有灰白色悬浮物,设计方案研究该悬浮物的组成,请帮助完善。(假设镁的化合物都溶于稀酸)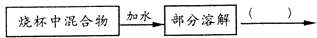
写出产生该灰白色悬浮物主要反应的化学方程式。
三、综合题
-
9. 氨为重要化工原料,有广泛用途。(1)、合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g) CO(g)+3H2(g) △H=+216.4kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g) CO2(g)+4H2(g) △H=。
(2)、起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。
①恒压时,反应一定达到平衡状态的标志是(填序号);
A.N2和H2的转化率相等
B.反应体系密度保持不变
C. 比值保持不变
D. =2
②P1P2 (填“>”、“<”、“=”、“不确定”,下同);反应平衡常数:B点D点;
③C点H2的转化率;在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:v(A) v(B)。
(3)、N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。①写出NH3和NaClO 反应生成N2H4的化学方程式;
②已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O N2H5++OH- K1=1×10-a;N2H5++H2O N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围(用含a、b式子表示)。
10. 高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2 , 还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。 (1)、配平焙烧时化学反应: MnO2+ +O2 K2MnO4+H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因。(2)、滤渣II 的成分有(化学式);第一次通CO2不能用稀盐酸代替的原因是。(3)、第二次通入过量CO2生成MnO2的离子方程式为。(4)、将滤液Ⅲ进行一系列操作得KMnO4。
(1)、配平焙烧时化学反应: MnO2+ +O2 K2MnO4+H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因。(2)、滤渣II 的成分有(化学式);第一次通CO2不能用稀盐酸代替的原因是。(3)、第二次通入过量CO2生成MnO2的离子方程式为。(4)、将滤液Ⅲ进行一系列操作得KMnO4。由下图可知,从滤液Ⅲ得到KMnO4需经过、、洗涤等操作。
 (5)、工业上按上述流程连续生产。含MnO2a%的软锰矿1吨,理论上最多可制KMnO4吨。(6)、利用电解法可得到更纯的KMnO4。用惰性电极电解滤液II。
(5)、工业上按上述流程连续生产。含MnO2a%的软锰矿1吨,理论上最多可制KMnO4吨。(6)、利用电解法可得到更纯的KMnO4。用惰性电极电解滤液II。①电解槽阳极反应式为;
②阳极还可能有气体产生,该气体是。
11. [化学一选修3:物质结构与性质]我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。(1)、Cu2+的未成对电子数有个,H、O、S 电负性由大到小的顺序为。(2)、在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。①[Cu(NH3)4]SO4中化学键类型有 , [Cu(NH3)4]2+ 的结构简式为 , 阴离子中心原子杂化类型为。
②氨的沸点远高于膦(PH3),原因是。
(3)、铁铜合金晶体类型为;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因。(4)、金铜合金的一种晶体结构为立方晶型,如图所示。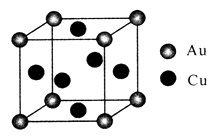
①该合金的化学式为;
②已知该合金的密度为dg/cm3 , 阿伏加德罗常数值为NA , 两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为cm(写出计算表达式)。
12. 用石油产品A(C3H6)为主要原料,合成具有广泛用途的有机玻璃PMMA。流程如下(部分产物和条件省略)
试回答下列问题:
(1)、B的名称;X试剂为(化学式);D中官能团名称。(2)、E→G的化学方程式为 , 反应类型是。(3)、T是G的同分异构体,1molT与足量新制Cu(OH)2悬浊液反应最多生成2molCu2O沉淀,T的结构有种(不含立体结构)。(4)、若高分子化合物PMMA的相对分子质量为1.5×106 , 其聚合度为。(5)、参照上述流程,以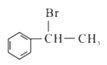 为原料合成
为原料合成 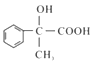 (其它原料自选)。设计合成路线:。
(其它原料自选)。设计合成路线:。
-