四川省成都市2017-2018学年高三理综-化学二模考试试卷
试卷更新日期:2018-05-08 类型:高考模拟
一、单选题
-
1. 《周礼)记载“煤饼烧砺(贝壳)成灰”,并把这种灰称为“蜃”,古人蔡伦以“蜃”改进了造纸术。下列说法错误的是( )A、贝壳的主要成分CaCO3 B、“砺成灰”是氧化还原反应 C、“蜃”与水混合,溶液呈碱性 D、纸张主要成分是纤维素2. 下列描述正确的是( )A、葡萄糖和麦芽糖属于同系物 B、苯和甲苯可以用溴水鉴别 C、植物油水解属于取代反应 D、用NaOH溶液可以除去乙酸乙酯中的乙酸3. 2016年命名第七周期VIIA元素Ts为钿(tian)。下列利用元素周期律的相关推测错误的是( )A、Ts为金属元素 B、原子半径:Ts>Br>O C、Ts的主要化合价-1、+7 D、酸性:HClO4>HTsO44. 对某溶液中部分离子的定性检测流程如下。相关分析正确的是( )
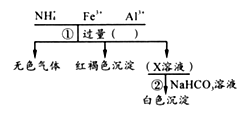 A、步骤①所加试剂可以是浓KOH 溶液 B、可以用湿润的蓝色石蕊试纸检验生成的无色气体 C、步骤②反应Al3++3HCO3-=Al(OH)3↓+3CO2↑ D、Fe2+ 遇铁氰化钾溶液显蓝色5. 最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时,电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是( )
A、步骤①所加试剂可以是浓KOH 溶液 B、可以用湿润的蓝色石蕊试纸检验生成的无色气体 C、步骤②反应Al3++3HCO3-=Al(OH)3↓+3CO2↑ D、Fe2+ 遇铁氰化钾溶液显蓝色5. 最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时,电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是( )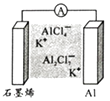 A、放电时,Cn(石墨烯)为负极 B、放电时,Al2Cl7-在负极转化为AlCl4- C、充电时,阳极反应为4Al2Cl7-+3e-=Al+7AlCl4- D、以轻金属为负极有利于提高电池的能量密度6. 某同学利用下列装置探究Na与CO2反应的还原产物,已知PdCl2+CO+H2O=Pd(黑色)↓+CO2+2HCl。下列相关分析错误的是( )
A、放电时,Cn(石墨烯)为负极 B、放电时,Al2Cl7-在负极转化为AlCl4- C、充电时,阳极反应为4Al2Cl7-+3e-=Al+7AlCl4- D、以轻金属为负极有利于提高电池的能量密度6. 某同学利用下列装置探究Na与CO2反应的还原产物,已知PdCl2+CO+H2O=Pd(黑色)↓+CO2+2HCl。下列相关分析错误的是( )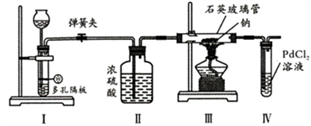 A、I中发生反应可以是Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ B、II中浓硫酸的目的是干燥CO2 C、实验时,III中石英玻璃管容易受到腐蚀 D、步骤IV的目的是证明还原产物是否有CO7. 常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是( )
A、I中发生反应可以是Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ B、II中浓硫酸的目的是干燥CO2 C、实验时,III中石英玻璃管容易受到腐蚀 D、步骤IV的目的是证明还原产物是否有CO7. 常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是( ) A、水解常数:X->Y- B、10.00mL时,有c(Na+)>c(HX)>c(X-)>c(H+) C、pH=7时,c(Y-)>c(X-) D、a、b两点溶液混合后,c(HX)+c(HY)+c(H+)=c(OH-)
A、水解常数:X->Y- B、10.00mL时,有c(Na+)>c(HX)>c(X-)>c(H+) C、pH=7时,c(Y-)>c(X-) D、a、b两点溶液混合后,c(HX)+c(HY)+c(H+)=c(OH-)二、综合题
-
8. 工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下。
主反应 2CH3CH2OH CH3CH2OCH2CH3+H2O
副反应CH3CH2OH H2C=CH2 ↑+H2O

【乙醚制备】装置设计如下图(部分装置略)
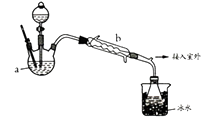 (1)、仪器a是(写名称);仪器b应更换为下列的(填序号)。
(1)、仪器a是(写名称);仪器b应更换为下列的(填序号)。A.干燥器
B.直形冷凝管
C.玻璃管
D.安全瓶
(2)、实验操作的正确排序为(填序号),取出乙醚立即密闭保存。a.安装实验仪器 b.加入12 mL浓硫酸和少量乙醇的混合物 c.检查装置气密性 d.熄灭酒精灯 e.通冷却水并加热烧瓶 f.拆除装置 g.控制滴加乙醇速率与馏出液速率相等
(3)、加热后发现a 中没有添加碎瓷片,处理方法是;反应温度不超过145℃,其目的是。若滴入乙醇的速率显著超过馏出液速率,反应速率会降低,可能原因是。(4)、【乙醚提纯】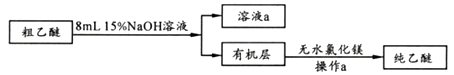
粗乙醚中含有的主要杂质为;无水氯化镁的作用是。
(5)、操作a 的名称是;进行该操作时,必须用水浴代替酒精灯加热,其目的与制备实验中将尾接管支管通入室外相同,均为。9. 工业上可通过煤的液化合成甲醇,主反应为:CO(g)+2H2(g) CH3OH(l) △H=x。
(1)、已知常温下CH3OH、H2和CO 的燃烧热分别为726.5 kJ/mol、285.5 kJ/mol、283.0 k J/mol,则x=;为提高合成甲醇反应的选择性,关键因素是。(2)、TK下,在容积为1.00 L的某密闭容器中进行上述反应,相关数据如图一。①该化学反应0~10 min的平均速率v(H2)=;M和N点的逆反应速率较大的是(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10 min时容器内CO的体积分数为。
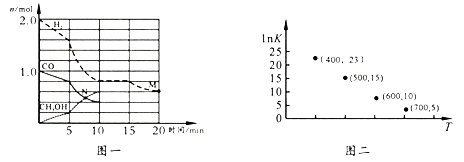
③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK 下平衡气体总压强为x atm,则该反应KP=(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K 的自然对数)如图二,请分析1nK 随T呈现上述变化趋势的原因是。
(3)、干燥的甲醇可用于制造燃料电池。①研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为;
②某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C 和O2。其阳极电极反应式为。
10. BaCl2可用于电子、仪表等工业。以毒重石(主要成分BaCO3 , 含少量CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业提取BaCl2·2H2O的流程如下: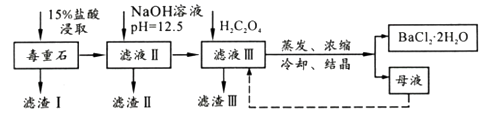
已知:①Ksp(BaC2O4)=1.6×10-7 , Ksp(CaC2O4)=2.3×10-9
②离子浓度小于至1×10-5认为沉淀完全。
Ca2+
Mg2+
Fe3+
开始沉淀时的pH
11.9
9.1
1.9
完全沉淀时的pH
13.9
11.0
3.7
(1)、滤渣I的成分为(填化学式),过滤所需玻璃仪器有。(2)、加入NaOH溶液后所得滤液III中,含有的Mg2+浓度为;加入H2C2O4时应避免过量,其原因是。(3)、BaCl2母液中除了含有Ba+、Cl-外,还含有大量的(填离子符号)。有人从“绿色化学”角度设想将“母液”沿虚线进行循环使用,请分析在实际工业生产中是否可行,(填“可行”或“不可行”),理由是。(4)、滤渣III是结石的主要成分,现将滤渣III 经过洗涤干燥后在有氧环境下进行热重分析,取146.0g灼烧,所得参数如下表。温度(℃)
常温
190〜200
470〜480
质量(g)
146.0
128.0
100.0
滤渣III 的成分是(填化学式);200~470℃时发生反应的化学方程式为。
11. [化学一物质结构与性质]硒化锌是一种半导体材料,回答下列问题。
(1)、锌在周期表中的位置;Se基态原子价电子排布图为。元素锌、硫和硒第一电离能较大的是(填元素符号)。(2)、Na2SeO3分子中Se 原子的杂化类型为;H2SeO4的酸性比H2SeO3强,原因是。(3)、气态SeO3分子的立体构型为;下列与SeO3互为等电子体的有(填序号)。A.CO32-
B.NO3-
C.NCl3
D.SO32-
(4)、硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为(填元素符号);该晶胞中硒原子所处空隙类型为(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为;若该晶胞密度为pg·cm-3 , 硒化锌的摩尔质量为Mg·mol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a 为nm。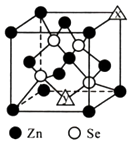 12. [化学一有机化学基础]
12. [化学一有机化学基础]防晒剂(M)CH3O
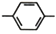 CH=CHCOOCH2CH2CH2CH3的合成路线如下,根据信息回答下列问题:
CH=CHCOOCH2CH2CH2CH3的合成路线如下,根据信息回答下列问题: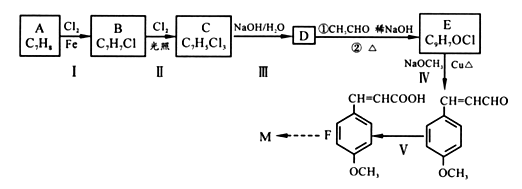
已知:①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
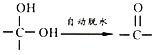
②
 (1)、M中醚键是一种极其稳定的化学键,除此之外还含有官能团的名称为。(2)、A的核磁共振氢谱中显示有种吸收峰;物质B的名称。(3)、C 的结构简式;D→E转化过程中第①步的化学反应方程式。(4)、完成V的反应条件是;IV 的反应类型为。(5)、A也是合成阿司匹林(
(1)、M中醚键是一种极其稳定的化学键,除此之外还含有官能团的名称为。(2)、A的核磁共振氢谱中显示有种吸收峰;物质B的名称。(3)、C 的结构简式;D→E转化过程中第①步的化学反应方程式。(4)、完成V的反应条件是;IV 的反应类型为。(5)、A也是合成阿司匹林(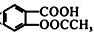 )的原料,
)的原料, 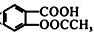 有多种同分异构体。写出符合下列条件的同分异构体的结构简式(任写出一种 )。
有多种同分异构体。写出符合下列条件的同分异构体的结构简式(任写出一种 )。a.苯环上有3 个取代基
b.仅属于酯类,能发生银镜反应,且每摩该物质反应时最多能生成4molAg
c.苯环上的一氯代物有两种
(6)、以F及乙醛为原料,合成防哂剂CH3O CH=CHCOOCH2CH2CH2CH3的路线为(用流程图表示)。流程示例:CH2=CH2 CH3CH2Br CH3CH2OH
CH=CHCOOCH2CH2CH2CH3的路线为(用流程图表示)。流程示例:CH2=CH2 CH3CH2Br CH3CH2OH