广东省珠海市高三2017-2018学年高三理综-化学一模考试试卷
试卷更新日期:2018-05-08 类型:高考模拟
一、单选题
-
1. 化学与生产,生活密切相关。下列说法正确的是( )
A、在燃放烟花爆竹时,硫燃烧生成SO3 B、六水氯化钙可用作食品干燥剂 C、太阳能电池板的材料是二氧化硅 D、乙烯可做水果的催熟剂2. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、18gD2O和18gH2O中含有的质子数均为10NA B、含2molH2SO4的浓硫酸和足量的Cu反应可生成NA个SO2分子 C、标准状况下,22.4LN2和H2混合气中含4NA个原子 D、过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA3. W、X、Y、Z是短周期元素,原子序数依次递增。W与Y位于同一主族,X的单质既能与盐酸反应也能与NaOH溶液反应,Y原子的最外层电子数是次外层电子数的一半,X、Y、Z原子的最外层电子数之和为14。下列说法正确的是( )A、X的阳离子半径比O2-半径大 B、最简单的气态氢化物的稳定性:Y<W<Z C、W、Y、Z最高价氧化物对应水化物酸性的强弱顺序为:Z<Y<W D、X与Z形成的化合物的水溶液pH>74. 乙醇、A,B都是重要的有机化工原料,其中A,B是常见的不饱和烃,B分子中含碳量最高,各物质的转化关系如图,则下列说法错误的是( ) A、由题目推出:A是乙烯,B是乙炔 B、反应①、②、③的反应类型相同 C、A,B,D,E均能使酸性KMnO4溶液褪色 D、有机物F中所有原子一定在同一平面上5. 用下图装置模拟制备氮化钙(化学式为Ca3N2 , 极易与H2O反应),下列说法错误的是( )
A、由题目推出:A是乙烯,B是乙炔 B、反应①、②、③的反应类型相同 C、A,B,D,E均能使酸性KMnO4溶液褪色 D、有机物F中所有原子一定在同一平面上5. 用下图装置模拟制备氮化钙(化学式为Ca3N2 , 极易与H2O反应),下列说法错误的是( ) A、打开活塞K通入N2 , 试管A内有气泡产生,说明装置气密性良好 B、U形管中盛放的干燥剂可以是碱石灰,但不能用浓硫酸 C、反应结束后,先熄灭酒精灯,待反应管冷却至室温后再关闭活塞K D、将产物Ca3N2放入盐酸中,能得到CaCl2和NH4Cl两种盐6. 最近科学家利用下图装置成功地实现了CO2和H2O合成CH4 , 下列叙述错误的是( )
A、打开活塞K通入N2 , 试管A内有气泡产生,说明装置气密性良好 B、U形管中盛放的干燥剂可以是碱石灰,但不能用浓硫酸 C、反应结束后,先熄灭酒精灯,待反应管冷却至室温后再关闭活塞K D、将产物Ca3N2放入盐酸中,能得到CaCl2和NH4Cl两种盐6. 最近科学家利用下图装置成功地实现了CO2和H2O合成CH4 , 下列叙述错误的是( )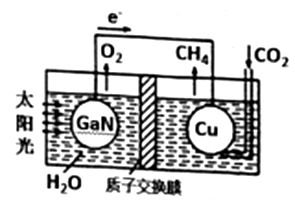 A、电池工作时,实现了将太阳能转化为电能 B、铜电极为正极,电极反应式为CO2+8eˉ+8H+=CH4+2H2O C、电池内H+透过质子交换膜从右向左移动 D、为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸7. 常温下,向20mL0.2mol·L-1的H2SO3溶液中滴加0.2mol·L-1 NaOH溶液,含硫微粒的物质的量(n)变化曲线如图所示,下列有关说法正确的是( )
A、电池工作时,实现了将太阳能转化为电能 B、铜电极为正极,电极反应式为CO2+8eˉ+8H+=CH4+2H2O C、电池内H+透过质子交换膜从右向左移动 D、为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸7. 常温下,向20mL0.2mol·L-1的H2SO3溶液中滴加0.2mol·L-1 NaOH溶液,含硫微粒的物质的量(n)变化曲线如图所示,下列有关说法正确的是( ) A、曲线Ⅱ代表H2SO3的浓度 B、a、b、c三个交点处水的电离程度大小:a<b<c C、当V(NaOH)=20mL时,溶液中各离子浓度的大小顺序为:c(Na+)>(HSO3ˉ)>c(SO32-)>c(H+)>c(OHˉ) D、若c点pH=6.5,则Ka2(H2SO3)=10-7.5
A、曲线Ⅱ代表H2SO3的浓度 B、a、b、c三个交点处水的电离程度大小:a<b<c C、当V(NaOH)=20mL时,溶液中各离子浓度的大小顺序为:c(Na+)>(HSO3ˉ)>c(SO32-)>c(H+)>c(OHˉ) D、若c点pH=6.5,则Ka2(H2SO3)=10-7.5二、实验题
-
8. 甲醛(HCHO),无色气体,易溶于水,有特殊的刺微气味,对人眼、鼻等有刺激作用。40%甲醛溶液沸点为96℃,易挥发。甲醛在碱性溶液中具有极强的还原性。为探究过量甲醛和新制Cu(OH)2反应的产物成分,进行如下研究:
(1)、在下图装置中进行实验,向a中加入0.5mol·L-1CuSO4溶液50mL和5 mol·L-1 NaOH溶液100mL,振荡,再加入40%的甲醛溶液40mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
①仪器b的名称是。
②仪器c的作用为。
③能说明甲醛具有还原性的实验现象是。
(2)、查阅资料发现气体产物是副反应产生的。为确认气体产物中含H2不含CO,将装置A和如下图所示的装置连接后进行实验。
①依次连接的合理顺序为:A→B→→→→→G,
②装置B的作用是。
③确认气体产物中含H2而不含CO的现象是。
(3)、已知: 。证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液, , 则说明甲醛的碳元素未被氧化成+4价。 (4)、为研究红色固体产物的组成,进行如下实验(以下每步均充分反应);
。证明a中甲醛的碳元素未被氧化成+4价的实验方案为:取少量a中反应后的清液, , 则说明甲醛的碳元素未被氧化成+4价。 (4)、为研究红色固体产物的组成,进行如下实验(以下每步均充分反应);
已知:ⅰ.Cu2O [Cu(NH3)4]+(无色) [Cu(NH3)4]2+(蓝色)
ⅱ.2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
通过上述实验,可以得出红色固体产物主要是。
9. 用氟硅酸(H2SiF6)制备冰晶石(Na3AlF6)的工艺流程如下所示: (1)、氟硅酸(H2SiF6)酸性强于硫酸,通常由四氟化硅经水吸收制得,其化学方程式为。(2)、反应②为脱硅工艺,滤渣②是。(3)、向NaF溶液中加入Al2(SO4)3溶液发生反应③的离子方程式为;NaF溶液呈碱性,在加入Al2(SO4)3溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物。(4)、干燥前,检验冰晶石是否洗涤干净的实验方法是。(5)、从母液中可循环利用的物质是。(6)、碳酸化法也是工业制取冰晶石的一种方法:在偏铝酸钠及氟化钠溶液中,通入足量二氧化碳即可,请写出该反应的化学方程式。
(1)、氟硅酸(H2SiF6)酸性强于硫酸,通常由四氟化硅经水吸收制得,其化学方程式为。(2)、反应②为脱硅工艺,滤渣②是。(3)、向NaF溶液中加入Al2(SO4)3溶液发生反应③的离子方程式为;NaF溶液呈碱性,在加入Al2(SO4)3溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物。(4)、干燥前,检验冰晶石是否洗涤干净的实验方法是。(5)、从母液中可循环利用的物质是。(6)、碳酸化法也是工业制取冰晶石的一种方法:在偏铝酸钠及氟化钠溶液中,通入足量二氧化碳即可,请写出该反应的化学方程式。三、综合题
-
10. 金属钒被誉为“合金的维生素”,常用于催化剂和新型电池。钒(V)在溶液中主要以VO43-(黄色)、VO2+(浅黄色)、VO2+ (蓝色)、V3+(绿色)、V2+(紫色)等形式存在。回答下列问题:(1)、已知:4Al(s)+3O2(g)=2Al2O3(s) △H1 4V(s)+5O2(g)=2V2O5(s) △H2
写出V2O5与Al 反应制备金属钒的热化学方程式。(反应热用△H1、△H2表示)
(2)、V2O5具有强氧化性,溶于浓盐酸可以得到蓝色溶液(含有VO2+),试写出V2O5与浓盐酸反应的化学反应方程式:。(3)、VO43-和V2O74-在pH≥13的溶液中可相互转化。室温下,1.0mol·L-1的Na3VO4溶液中c(VO43-)随c(H+)的变化如图所示。溶液中c(H+)增大,VO43-的平衡转化率(填“增大”“减小”或“不变”)。根据A点数据,计算该转化反应的平衡常数的数值为。 (4)、全钒液流电池是一种优良的新型蓄电储能设备,其工作原理如图2所示:
(4)、全钒液流电池是一种优良的新型蓄电储能设备,其工作原理如图2所示:①放电过程中,A电极的反应式为。
②充电过程中,B电极附近溶液颜色变化为。
③若该电池放电时的电流强度I=2.0A,电池工作10分钟,电解精炼铜得到铜mg,则电流利用率为(写出表达式,不必计算出结果。已知:电量Q=It,t为时间/秒;电解时Q=znF,z为每摩尔物质得失电子摩尔数,n为物质的量,法拉第常数F=96500C/mol,电流利用效率= ×100%)
11.(1)、固体可分为晶体、非晶体和准晶体三大类,可通过方法区分晶体、非晶体和准晶体,以色列科学家丹尼尔·谢赫特曼因发现锰的化合物准晶体而独享了2011年诺贝尔化学奖。基态Mn原子的电子排布式为。(2)、PCl3的立体构型为 , 中心原子的杂化轨道类型。(3)、硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。BF3
BCl3
BBr3
BI3
沸点/K
172
285
364
483
①四种卤化物沸点依次升高的原因是。
②B、C、N、O三种元素第一电离能由小到大的顺序为。
③用BF3分子结构解释反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生的原因:。
(4)、碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
回答下列问题
①石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm,其原因是金刚石中只存在C-C间的共价键,而石墨层内的C-C间存在键。
②金刚石晶胞含有个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,列式表示碳原子在晶胞中的空间占有率(不要求计算结果)。
四、推断题
-
12. 席夫碱主要是指含有亚胺或甲亚胺特性基团(-RC=N-)的一类有机化合物,常用作有机合成试剂和液晶材料。通常席夫碱是由胺和活性羰基缩合而成。某席夫碱类化合物G的一种合成路线如下:

已知以下信息
① ②1mol B经上述反应可生成2mol C,且C能发生银镜反应
②1mol B经上述反应可生成2mol C,且C能发生银镜反应③D属于单取代芳烃,其相对分子质量为92
④核磁共振氢谱显示F苯环上有两种化学环境的氢 ⑤
回答下列问题
(1)、由A生成B的化学方程式为 , 反应类型为。(2)、D的名称是 , 由D生成E的化学方程式为。(3)、G的结构简式为。(4)、C8H11N的同分异构体中含有苯环的共有种(不考虑立体异构),其中核磁共振氢谱为4组峰,且面积比为6:2:2:1的是(写出其中一种的结构简式)。(5)、上述合成路线,设计一条由苯及化合物C合成乙基苯胺( )的合成路线:
)的合成路线: