广东省茂名市2017-2018学年高三理综-化学第二次模拟考试试卷
试卷更新日期:2018-05-08 类型:高考模拟
一、单选题
-
1. 化学与生活、生产密切相关。下列叙述正确的是( )
A、酯在碱性条件下的水解反应叫皂化反应 B、橡胶、合成塑料、合成纤维均是人工合成的高分子材料 C、古代四大发明中“黑火药”的成分是“一硫二硝三木炭”,这里的“硝”指的足硝酸 D、《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐2. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )A、6.8 g熔融的KHSO4中含有的离子数为0.15 NA B、标准状况下,11.2 L乙酸中含有的碳碳键数为0.5NA C、N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ/mol,当转移的电子数为6NA时,该反应放 出 92.4 kJ的热量 D、常温常压下,4.4gCO2和N2O混合气体中含有的原子总数为0.6NA3. 有机物的结构可用“键线式”简化表示,如:CH3-CH=CH-CH3可表示为 ,有一种有机物X键线式为
,有一种有机物X键线式为  下列关于有机物X的叙述错误的是( )
下列关于有机物X的叙述错误的是( )
A、X的分子式为C8H8O3 B、有机物Y足X的同分异构体,含有苯环、能与NaHC03溶液反应、且有三个取代基,则Y的结构有8种 C、X分子中的所有原子不可能在同一平面内 D、X能发生加成反应,取代反应,并能使溴水、酸性KMnO4溶液褪色4. 下列实验操作、现象和结论均正确的是( )选项
实验操作
现象或化学方程式
结论
A
取1mL20%的蔗糖溶液,加入适量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2悬浊液,加热
溶液中未出现砖红色沉淀
蔗糖未水解
B
将C和SiO2的固体混合物高温加热
2C+SiO2 Si+2CO↑
非金属性:C>Si
C
向盛有2mL0.1mol/L的NaCl溶液的试管中逐滴加入几滴0.1mol/L的AgNO3溶液,充分反应后,再逐滴加入0.1mol/L的KI溶液
白色沉淀变为黄色沉淀
Ksp(AgCl)>Ksp(AgI)
D
向待测液中加入适量的稀NaOH溶液,将|湿润的蓝色石蕊试纸放在试管口
湿润的蓝色石蕊试纸未变红
在待测液中不存在NH4+
A、A B、B C、C D、D5. H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是( ) A、a是负极,电池工作时,电子的流动力向是:电极a-负载一电极b-质子膜一电极a B、电池工作时,化学能转化为电能和热能 C、电极b上发生的电极反应式为O2+ 4e-+4H+=2H2O D、当电路中通过4mol电子时,有4molH+经质子膜进入正极区6. 前20号元素M、W、X、Y、Z的原子序数依次增大,M和W形成的某种化合物可作制冷剂,Y 和Z能形成ZY2型离子化合物,其电子总数为38。下列有关叙述正确的是( )A、W和X形成的化合物只有5种 B、M和W可以形成离子化合物 C、W、X、Y三种元素的简单氢化物的沸点:Y>X>W D、X和Z形成的化合物ZX2中,阳离子和阴离子的数目之比为1:27. 已知部分弱酸的电离平衡常数如下表:
A、a是负极,电池工作时,电子的流动力向是:电极a-负载一电极b-质子膜一电极a B、电池工作时,化学能转化为电能和热能 C、电极b上发生的电极反应式为O2+ 4e-+4H+=2H2O D、当电路中通过4mol电子时,有4molH+经质子膜进入正极区6. 前20号元素M、W、X、Y、Z的原子序数依次增大,M和W形成的某种化合物可作制冷剂,Y 和Z能形成ZY2型离子化合物,其电子总数为38。下列有关叙述正确的是( )A、W和X形成的化合物只有5种 B、M和W可以形成离子化合物 C、W、X、Y三种元素的简单氢化物的沸点:Y>X>W D、X和Z形成的化合物ZX2中,阳离子和阴离子的数目之比为1:27. 已知部分弱酸的电离平衡常数如下表:弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
K=1.77×10-4
K=5.0×10-10
K1=4.3×10-7
K2=5.6×10-11
下列叙述错误的是( )
A、NaCN溶液中通入少量CO2发生的离子反应为:CN-+H2O+CO2=HCN+HCO3- B、等体积、等物质的量浓度的HCOONa和NaCN溶液中所含阴离子总数前者大于后者 C、等物质的量浓度的NaHCO3和Na2CO3混合溶液中:c(Na+)>c(OH-)>c(HCO3-)>c(CO32-)>c(H+) D、中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者二、综合题
-
8. ICl(氯化碘)红棕色液体,熔点13.9℃,沸点97 4℃,易水解,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组的同学拟用下列仪器制备氯化碘。回答下列问题:

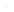 (1)、检查A装置气密性的方法为。(2)、上述装置,按气流方向连接的顺序为(装置可重复使用),A中发生反应的离子方程式为。(3)、C装置的作用是。(4)、E装置的烧瓶反应时需放在水中,控制温度大约40℃,其目的是。(5)、按上述连接好的装置进行实验,实验步骤如下:
(1)、检查A装置气密性的方法为。(2)、上述装置,按气流方向连接的顺序为(装置可重复使用),A中发生反应的离子方程式为。(3)、C装置的作用是。(4)、E装置的烧瓶反应时需放在水中,控制温度大约40℃,其目的是。(5)、按上述连接好的装置进行实验,实验步骤如下:①检查装置气密性后,装入药品 ②打开分液漏斗活塞 ③关闭分液漏斗活塞 ④停止加热E,充分冷却 ⑤水浴加热E
请按符合题意的顺序填入上述步骤的序号。
(6)、在A装置后可连接如图的装置,当反应结束关闭分液漏斗活塞后,关闭K,该装置的作用是。 (7)、ICl和水反应的化学方程式为。9. 电解法生产锰时会产生大量的阳极泥,其主要成分为MnO2和Pb,还含有少量其他金属化合物。下图是回收电解锰阳极泥生产MnCO3的工艺流程。
(7)、ICl和水反应的化学方程式为。9. 电解法生产锰时会产生大量的阳极泥,其主要成分为MnO2和Pb,还含有少量其他金属化合物。下图是回收电解锰阳极泥生产MnCO3的工艺流程。
已知:Al(OH)3、Mn(OH)2、MnCO3的Ksp分别为1.0×10-33、1.9×10-13、2.2×10-11。
(1)、“还原酸浸”时氧化产物为CO2 , 发生反应的化学方程式为。(2)、“还原酸浸”实验中,锰的浸出率结果如图所示。由图可知,所采用的最佳实验条件为 。 (3)、滤液Ⅰ中的阳离子组成见下表:
(3)、滤液Ⅰ中的阳离子组成见下表:组成
Mn2+
Fe2+
Fe3+
Al3+
浓度/(mol·L-1)
0.85
2.4×10-3
1.0×10-2
2.0×10-3
“除杂”时先加MnO2 , MnO2的作用为 。
再加氨水调节pH使杂质离子沉淀完全,通过计算说明Al3+沉淀完全时Mn2+是否开始沉淀 。
(4)、“沉锰”时发生反应的离子方程式为 。(5)、“沉锰”的关键操作有2点:①将NH4HCO3溶液滴入MnSO4溶液中;②反应终点pH=7。如果颠倒试剂滴加顺序,将MnSO4溶液滴入NH4HCO3 , 溶液中,或反应终点pH>7可能造成同样的后果,该后果是;如粜反应终点pH<7,可能的后果是。(6)、从滤液2中回收得到的副产品的用途为。10. 甲醇是一种可再生能源,具有开发和应用的广阔前景,其合成反应为CO(g)+2H2(g) CH3OH(g)。(1)、下表列出了一些化学键断裂需要的能量数据,则CO(g)+2H2(g) CH3OH(g) △H=。化学键
H-H
C-O
C O
H-O
C-H
E(kJ·mol-1)
436
343
1076
465
413
(2)、工业上用天然气为原料合成甲醇,分为两阶段。①制备合成气:CH4+H2O(g)=CO+3H2。
为解决合成气中H2过量CO不足问题,原料气中添加CO2 , 发生反应CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
②合成甲醇
实验室进行模拟合成实验。将1 molCO和2molH2通入密闭容器中,测得CO在不同温度下的平衡转化率与压强的关系如图所示:

比较T1、T2、T3的大小,并说明理由。
(3)、平衡常数K(b) K(d)、正反应速率v(a) v(b)(均填“大于”“小于”或“等于”)。(4)、c点时反应的压强平衡常数Kp= (kPa)-2(用数字表达式表示,Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。(5)、a点时,保持温度不变,将密闭容器的容积压缩刮原来的,对平衡体系产生的影响是______。A、c(H2)减少 B、正反应速率加快,逆反应速率减慢 C、CH3OH的物质的量增加 D、重新平衡时 减小 E、CH3OH的体积分数增加(6)、科研人员设计了一种新型甲醇燃料电池,其电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2- , 该电池工作时的负极电极反应式为 。11. H、N、Na、Al、Ti等元素在能源、材料等领域应用广泛。回答下列问题:(一)氢化铝钠( NaAlH4)是一种新型轻质储氢材料,掺人少量Ti的NaAlH4在150℃时释氢,在170℃、15.2 MPa条件下又重复吸氢。NaAlH4可南AlCl3和NaH在适当条件下合成。NaAlH4的品胞结构如右图所示,为长方体。
 (1)、基态Ti原子的价电子排布式为 , L能层中电子云的形状有 种。(2)、AlCl3在178℃时升华,属于晶体,其蒸气的相对分子质量约为267,蒸气分子的结构式为(标明配位键),其中Al原子的杂化方式为。(3)、写出与AIH4-空间构型相同的-种分子和一种离子(填化学式)。(4)、NaAlH4晶体中,与AlH4紧邻且等距的Na+有个;NaAlH4晶体的密度为 g/cm3(用含n的代数式表示)。(5)、(二)叠氮化钠和氢叠氮酸( HN3)已一步步进入我们的生活,如汽车安全气囊等。
(1)、基态Ti原子的价电子排布式为 , L能层中电子云的形状有 种。(2)、AlCl3在178℃时升华,属于晶体,其蒸气的相对分子质量约为267,蒸气分子的结构式为(标明配位键),其中Al原子的杂化方式为。(3)、写出与AIH4-空间构型相同的-种分子和一种离子(填化学式)。(4)、NaAlH4晶体中,与AlH4紧邻且等距的Na+有个;NaAlH4晶体的密度为 g/cm3(用含n的代数式表示)。(5)、(二)叠氮化钠和氢叠氮酸( HN3)已一步步进入我们的生活,如汽车安全气囊等。写出与N3-互为等电子体的一种分子填分子式)。
(6)、氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是(填标号)A上述生成HN3的化学方程式为:N2H4+HNO2=HN3+2H2O
B NaN3的晶格能大于KN3的晶格能
C氢叠氮酸(HN3)和水能形成分子间氢键
D HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E HN3分子中四个原子可能在一条直线上
三、推断题
-
12. 某新型有机酰胺化合物M在l业生产中有重要的作用,其合成路线如下:

已知:①A是烃的含氧衍生物,相对分子质量为58,碳和氢的质量分数之和为44.8%,核磁共振氢谱显示为一组峰,可发生银镜反应。

回答下列问题:
(1)、E的结构简式为 , G的名称为(2)、B中含有官能团的名称为。(3)、C-D的反应类型为 。(4)、写出 F+H—M的化学反应方程式。(5)、芳香族化合物W有三个取代基,是C的同分异构体,能与FeCl3溶液发生显色反应。 0.5 molW可与足量的Na反应生成1gH2 , H核磁共振氢谱显示为五组峰,符合以上条件的W的同分异构体共有 种,写出其中一种的结构简式。(6)、参照上述合成路线.以CH2=CH2和HOCH2CH2OH为原料(无机试剂任选),设计制备 的合成路线。
的合成路线。