广东省惠州市2017-2018学年高三理综-化学第三次模拟考试试卷
试卷更新日期:2018-05-08 类型:高考模拟
一、单选题
-
1. 下列生活用品的主要成分属于有机高分子物质的是( )A、花生油 B、味精 C、紫砂壶 D、面巾纸2. 设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )A、标准状况下,22.4 L四氯化碳中含有C-Cl数目为4NA B、1 mol Cl2通入足量水中反应转移的电子数为NA C、常温下,0.5 mol•L﹣1 Fe2(SO4)3溶液中含Fe3+数目为1 NA D、常温常压下,5.6 g丙烯和环丙烷的混合气体中含有的碳原子数为0.4 NA3. 下列关于有机化合物的说法正确的是( )A、分子式为C3H6Cl2的有机物有4种同分异构体(不考虑立体异构) B、
 和
和  互为同系物
C、乙炔和溴的四氯化碳溶液反应生成1,2-二溴乙烷
D、甲苯分子中所有原子都在同一平面上
4. 已知X、Y、Z、T、W是短周期中原子序数依次增大的5种主族元素,其中X、T同主族,X与Y形成的简单气态化合物能使湿润的红色石蕊试纸变蓝,Z原子的最外层电子数是电子层数的3倍,W是一种重要的半导体材料。下列说法正确的是( )A、原子半径: X<Y<Z<T B、Y元素的含氧酸都属于强酸 C、Z、T和W三种元素形成的化合物的水溶液呈碱性 D、元素Z、T组成的化合物中阴阳离子个数之比为2∶15. 下列图示与对应的叙述不相符合的是( )
互为同系物
C、乙炔和溴的四氯化碳溶液反应生成1,2-二溴乙烷
D、甲苯分子中所有原子都在同一平面上
4. 已知X、Y、Z、T、W是短周期中原子序数依次增大的5种主族元素,其中X、T同主族,X与Y形成的简单气态化合物能使湿润的红色石蕊试纸变蓝,Z原子的最外层电子数是电子层数的3倍,W是一种重要的半导体材料。下列说法正确的是( )A、原子半径: X<Y<Z<T B、Y元素的含氧酸都属于强酸 C、Z、T和W三种元素形成的化合物的水溶液呈碱性 D、元素Z、T组成的化合物中阴阳离子个数之比为2∶15. 下列图示与对应的叙述不相符合的是( )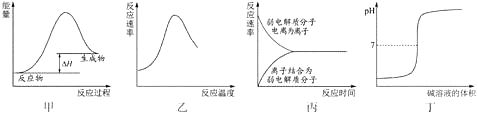 A、图甲表示燃料燃烧反应的能量变化 B、图乙表示酶催化反应的反应速率随反应温度的变化 C、图丙表示弱电解质在水中建立电离平衡的过程 D、图丁表示强碱滴定强酸的滴定曲线6. 25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是( )
A、图甲表示燃料燃烧反应的能量变化 B、图乙表示酶催化反应的反应速率随反应温度的变化 C、图丙表示弱电解质在水中建立电离平衡的过程 D、图丁表示强碱滴定强酸的滴定曲线6. 25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是( ) A、随pH增大, 数值先减小后增大 B、b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3- ) C、25℃时,碳酸的第一步电离常数Ka1=10-7 D、溶液呈中性时:c(HCO3- )>c(CO32-)>c(H2CO3)7. 全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+ , 下列说法正确的是( )
A、随pH增大, 数值先减小后增大 B、b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)+c(HCO3- ) C、25℃时,碳酸的第一步电离常数Ka1=10-7 D、溶液呈中性时:c(HCO3- )>c(CO32-)>c(H2CO3)7. 全钒氧化还原电池是一种新型可充电池,不同价态的含钒离子作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为:V2+-e-=V3+ , 下列说法正确的是( ) A、放电时,右槽发生还原反应 B、放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O C、充电时,每转移1mol电子,n(H+)的变化量为1mol D、充电时,阴极电解液pH升高
A、放电时,右槽发生还原反应 B、放电时,左槽的电极反应式:VO2++2H++e-=VO2++H2O C、充电时,每转移1mol电子,n(H+)的变化量为1mol D、充电时,阴极电解液pH升高二、实验题
-
8. 实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g) NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。(1)、该反应在一定条件下能够自发进行,则反应的ΔH0。(填大于、小于或等于)(2)、写出生成碳酸氢铵的化学方程式。(3)、实验步骤如下:

步骤1:按图所示组装仪器,检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是。
②对比碳酸盐和酸反应制CO2 , 该实验利用干冰升华产生CO2气体的优点有 , 。
③以恒压滴液漏斗代替分液漏斗的目的是。
④反应后期CO2气流量下降时,可采取的相应措施是。
(4)、该实验装置中可能存在的缺陷是。9. 用金属钴板(含少量Fe、Ni)制备应用广泛的氯化钴的工艺流程如下:
注:钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产。
有关钴、镍和铁化合物的性质见下表:
化学式
沉淀完全时的pH
钴镍性质
Co(OH)2
9.4
Co+2HCl=CoCl2+H2↑
Co2++2NH3·H2O=Co(OH)2↓+2NH4+
Co2++2H2O
 Co(OH)2+2H+
Co(OH)2+2H+Ni+2HCl=NiCl2+H2↑
Ni2++6NH3·H2O=[Ni(NH3)6]2++6H2O
Fe(OH)2
9.6
Fe (OH)3
3.7
(1)、“除镍”步骤中,NH3·H2O用量对反应收率的影响见表中数据:从表中数据可知,当PH调节至x=时,除镍效果最好。加NH3·H2O调pH
收率/%
Ni2+含量/%
9
98.1
0.08
9.5
98
0.05
10
97.6
0.005
10.3
94
0.005
(2)、“除镍”步骤必须控制在一定的时间内完成,否则沉淀中将有部分Co(OH)2转化为Co(OH)3 , 此反应的化学方程式为。(3)、“除铁”步骤中加入双氧水发生反应的离子方程式是。(4)、“除铁”步骤中加入的纯碱作用是。(5)、在“调pH”步骤中,加盐酸的作用是。(6)、已知25℃时,Ksp[Fe(OH)3]=4.0×10-38 , 则该温度下反应Fe3++3H2O Fe(OH)3+3H+的平衡常数为。
Fe(OH)3+3H+的平衡常数为。 三、综合题
-
10. 碘及其化合物在生产、生活和科技等方面都有着重要的应用。回答下列问题:(1)、已知:①2I2(s)+5O2(g)=2I2O5(s) ΔH=-1966 kJ•mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-1200 kJ•mol-1 。
则5CO(g)+I2O5(s)=5CO2(g)+I2(s)的△H= 。
(2)、碘不易溶于水,但易溶于碘化钾溶液并生成多碘离子,反应如下:① I2(s)+I-(aq) I3-(aq) △H<0; ② I2 (s)+2I-(aq) I42-(aq)。
温度降低时,反应①的平衡常数将(填“增大”“减小”或“不变”);反应②的平衡常数的表达式为K=。
(3)、碘与钨在一定温度下,可发生如下可逆反应:W(s)+I2(g) WI2(g)。现准确称取0.508g碘和0.736g金属钨放置于50.0mL的密闭容器中,并加热使其反应。如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃。
① 该反应△H0(填“>”或“<”)。
② 反应从开始到t1(t1= 3 min)时间内 I2 的平均反应速率v(I2)=。
③ 在450℃时,该反应的平衡常数K的值为。
④ 能够说明上述反应已经达到平衡状态的有 (填选项字母)。
A.I2与WI2的浓度相等
B. 容器内各气体的浓度不再改变
C. 容器内混合气体的密度不再改变
D.容器内气体压强不发生变化
11. 在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2A+3CO2↑+9H2O。根据题意完成下列填空:(1)、冰晶石的化学式为 , 含有离子键、等化学键。(2)、生成物中含有10个电子的分子是(写分子式),该分子的空间构型 , 中心原子的杂化方式为。(3)、反应物中电负性最大的元素为(填元素符号),写出其原子最外层的电子排布图:。(4)、冰晶石由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是(填微粒符号)。(5)、Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所示: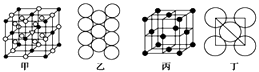
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为个; Al晶体的密度为(用字母表示)。
四、推断题
-
12. 我国化学家合成了一种新型除草剂的合成路线如下:
 (1)、① 中两种含氧官能团的名称、。除草剂⑦的分子式为 。(2)、③与⑥生成⑦的反应类型是 , ④
(1)、① 中两种含氧官能团的名称、。除草剂⑦的分子式为 。(2)、③与⑥生成⑦的反应类型是 , ④ ⑤转化中另外一种产物是HCl,则试剂X是 。 (3)、写出一种同时满足下列条件的物质③的同分异构体的结构简式。
⑤转化中另外一种产物是HCl,则试剂X是 。 (3)、写出一种同时满足下列条件的物质③的同分异构体的结构简式。① 属于芳香族化合物; ② 苯环上的一取代物只有两种;
③ 在铜催化下与O2反应,其生成物1 mol与足量的银氨溶液反应生成4 mol Ag
(4)、写出② ③的化学方程式。 (5)、卡巴拉丁是老年人认知障碍的重要治疗药物。请结合上述合成路线及下面所给的反应:
③的化学方程式。 (5)、卡巴拉丁是老年人认知障碍的重要治疗药物。请结合上述合成路线及下面所给的反应:
ROH+SOCl2
 RCl+HOSOCl
RCl+HOSOCl请写出合成卡巴拉丁流程中A、B、D的结构简式,C试剂的化学式。

A:、B:、C:、D:。