广东省佛山市普通高中2017-2018学年高三化学第二次模拟考试试卷
试卷更新日期:2018-05-08 类型:高考模拟
一、单选题
-
1. 2017年国产大飞机C919试飞成功,化学工作者研发的新材料发挥了重要作用。下列关于C919说法错误的是( )A、机身涂料中的氢氧化铝有阻燃作用 B、发动机使用的高温陶瓷材料氮化硅属于硅酸盐产品 C、使用的碳纤维复合材料能经受许多由温差带来的“冷冻热蒸”的考验 D、使用的第三代铝锂合金具有低密度、高比强度、优良的耐低温等性能2. 《唐本草》记载:……本来绿色,新出窟未见风者,正如璃璃。陶及今人谓之石胆,烧之赤色,故名绛矾矣”。文中“绛矾”为( )A、FeSO4·7H2O B、CuSO4·5H2O C、Na2SO4·10H2O D、KAl(SO4)2·12H2O3. 化合物结构简式如图,下列说法正确的是( )
 A、a、b、c均属于芳香烃 B、a、b、c 均能与钠反应产生氢气 C、a、b、c苯环上的二氯代物均有6种 D、a、b、c中所有碳原子不可能存在于同一平面中4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y最外层电子数相差1,Y 与Z同主族。装满XY2气体的小试管倒扣水槽中充分反应,试管液面上升2/3.下列说法正确的是( )A、Z、W的离子半径: Z<W B、X与Z可以存在于同一离子化合物中 C、X、Y对应的简单氢化物沸点: X>Y D、Y 与Z 形成的化合物溶于水形成的稀溶液能使紫色石蕊溶液褪色5. 锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是( )
A、a、b、c均属于芳香烃 B、a、b、c 均能与钠反应产生氢气 C、a、b、c苯环上的二氯代物均有6种 D、a、b、c中所有碳原子不可能存在于同一平面中4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X与Y最外层电子数相差1,Y 与Z同主族。装满XY2气体的小试管倒扣水槽中充分反应,试管液面上升2/3.下列说法正确的是( )A、Z、W的离子半径: Z<W B、X与Z可以存在于同一离子化合物中 C、X、Y对应的简单氢化物沸点: X>Y D、Y 与Z 形成的化合物溶于水形成的稀溶液能使紫色石蕊溶液褪色5. 锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是( ) A、该电池工作时Li+向负极移动 B、Li2SO4溶液可作该电池电解质溶液 C、电池充电时间越长,电池中Li2O 含量越多 D、电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O26. 298K时,二元弱酸H2X溶液中含X微粒的分布分数如图所示。下列叙述正确的是( )
A、该电池工作时Li+向负极移动 B、Li2SO4溶液可作该电池电解质溶液 C、电池充电时间越长,电池中Li2O 含量越多 D、电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O26. 298K时,二元弱酸H2X溶液中含X微粒的分布分数如图所示。下列叙述正确的是( ) A、溶液呈中性时: c(Na+)=2c(X2-) B、Ka2(H2X)为10-7 C、NaHX溶液c( H+)< c(OH-) D、溶液pH由1升至2.6时主要存在的反应是: H2X +OH-=HX-+ H2O7. 通过测定混合气中O2含量可计算已变质的Na2O2 (含Na2CO3) 纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是( )
A、溶液呈中性时: c(Na+)=2c(X2-) B、Ka2(H2X)为10-7 C、NaHX溶液c( H+)< c(OH-) D、溶液pH由1升至2.6时主要存在的反应是: H2X +OH-=HX-+ H2O7. 通过测定混合气中O2含量可计算已变质的Na2O2 (含Na2CO3) 纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是( )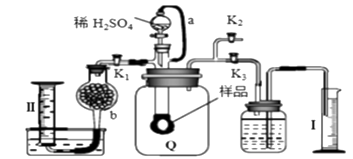 A、干燥管b中装入碱石灰 B、Q气球中产生的气体主要成分O2、CO2 C、测定气体总体积必须关闭K1、K2 , 打开K3 D、读完气体总体积后,关闭K3 , 缓缓打开K1;可观察到Q气球慢慢缩小
A、干燥管b中装入碱石灰 B、Q气球中产生的气体主要成分O2、CO2 C、测定气体总体积必须关闭K1、K2 , 打开K3 D、读完气体总体积后,关闭K3 , 缓缓打开K1;可观察到Q气球慢慢缩小二、实验题
-
8. 蒸馏碘滴定法可测量中药材中二氧化硫是否超标(亚硫酸盐折算成二氧化硫)。原理是利用如图装置将亚硫酸盐转化为SO2 , 然后通过碘标准溶液滴定吸收液。
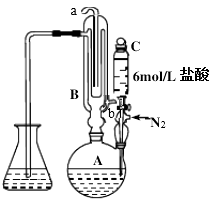
实验步骤如下:
I.SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300 mL; 锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液; 打开冷凝水,通氮气,滴入盐酸10mL; 加热烧瓶A并保持微沸约3min后,用0.01000mol/L 碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL;
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL.
(1)、仪器C的名称。仪器B的入水口为(填“a”或“b”)。(2)、滴入盐酸前先通氮气一段时间作用是 , 测定过程中氮气的流速过快会导致测量结果。(填“偏大”“偏小”“不变”)(3)、①滴定过程中使用的滴定管为。A.酸式无色滴定管
B.酸式棕色滴定管
C.碱式无色滴定管
D.碱式棕色滴定管
②滴定时锥形瓶中反应的离子方程式为 , 滴定终点的现象是。
(4)、空白实验的目的是。(5)、该中药中含SO2含量为mg/ kg。9. 二硫化钼(MoS2) 被誉为“固体润滑剂之王”,利用低品质的辉钼矿( 含MoS2、SiO2以及CuFeS2等杂质) 制备高纯二硫化钼的一种生产工艺如下:
回答下列问题:
(1)、钼酸铵的化学式为(NH4)2MoO4 , 其中Mo的化合价为.(2)、利用联合浸出除杂时,氢氟酸可除去的杂质化学式为如改用FeCl3溶液氧化浸出,CuFeS2杂质的浸出效果更好,写出氧化浸出时发生的化学反应方程式。(3)、加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)MoS4],写出(NH4)2MoS4与盐酸生成MoS3沉淀的离子反应方程式。(4)、由下图分析产生三硫化钼沉淀的流程中应选择的最优温度和时间是。
利用化学平衡原理分析低于或高于最优温度时,MoS3的产率均下降的原因:。
(5)、高纯MoS2中3然会存在极微量杂质,如非整比晶体MoS2.8 , 则该杂质中Mo4+与Mo6+的物质的量之比为。(6)、已知Ksp(BaSO4) =1.1×10-10 , Ksp(BaMoO4)=4.0×10-8),钼酸钠品体( NaMoO4·2H2O) 是新型的金属缓蚀剂,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO42-(溶液体积变化忽略),则当BaMoO4开始沉淀时,溶液中的c(MoO42-)/c(SO42-)(结果保留2位有效数字)三、填空题
-
10. 甲醇水蒸气重整制氢(SRM)系统简单,产物中H2 含量高、CO含量低(CO会损坏燃料电池的交换膜),是电动汽车氢氧燃料电池理想的氢源。反应如下:
反应Ⅰ(主) :CH3OH(g)+ H2O(g) CO2(g)+ 3H2(g) ΔH1=+49kJ/mol
反应Ⅱ(副) :H2(g)+ CO2(g) CO(g)+ H2O(g) ΔH2=+41kJ/mol
温度高于300℃则会同时发生反应Ⅲ: CH3OH(g) CO(g)+2H2(g) ΔH3
(1)、计算反应Ⅲ的ΔH3= 。(2)、反应1能够自发进行的原因是 , 升温有利于提高CH3OH转化率,但也存在一个明显的缺点是。(3)、下图为某催化剂条件下,CH3OH转化率、CO生成率与温度的变化关系。
①随着温度的升高,CO的实际反应生成率没有不断接近平衡状态生成率的原因是 (填标号)。
A.反应Ⅱ逆向移动
B.部分CO 转化为CH3OH
C.催化剂对反应Ⅱ的选择性低
D.催化剂对反应Ⅲ的选择性低
②随着温度的升高,CH3OH 实际反应转化率不断接近平衡状态转化率的原因是。
③写出一条能提高CH3OH转化率而降低CO生成率的措施。
(4)、250℃,一定压强和催化剂条件下,1.00molCH3OH 和1.32molH2O 充分反应(已知此条件下可忽略反应Ⅲ ),平衡时测得H2为2.70mol,CO有0.030mol,试求反应Ⅰ中CH3OH 的转化率 , 反应Ⅱ的平衡常数(结果保留两位有效数字)11. 硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:(1)、基态钒原子的外围电子轨道表达式为 , 钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是 , VO43-的几何构型为.(2)、2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。
①基态S原子中原子核外未成对电子数为 , 该药物中S原子的杂化方式是.所含第二周期元素第一电离能按由大到小顺序的排列是.
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是.
(3)、多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是_____.A、SO2 B、SO42- C、H2S D、CS2(4)、某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为。图4 为该晶胞的俯视图,该晶胞的密度为g/cm3 (列出计算式即可)。
四、推断题
-
12. 化合物F具有独特的生理药理作用,实验室由芳香化合物A制备下的一种合成路线如下:

已知:①

②

回答下列问题:
(1)、A的名称为 , B生成C的反应类型为。(2)、咖啡酸的结构简式为。(3)、F中含氧官能团名称为。(4)、写出F与足量NaOH溶液反应的化学方程式(5)、G为香兰素的同分异构体,能使FeCl3溶液变紫色,苯环上只有两个取代基团,能发生水解反应,符合要求的同分异构体有种,请写出其中核磁共振氢谱图显示有4种不同环境的氢,峰面积比为3:2:2:1的G的结构简式。(6)、写出以 原料(其他试剂任选) 制备肉桂酸(
原料(其他试剂任选) 制备肉桂酸(  )的合成路线。
)的合成路线。