江苏省扬州市2016-2017学年高一下学期化学期末考试试卷
试卷更新日期:2018-05-03 类型:期末考试
一、单选题
-
1. “低碳经济,节能减排”是当今世界经济发展的新思路。下列行为与之相悖的是( )A、开发风能、太阳能等新能源 B、回收处理工业废气 C、大力发展新能源汽车 D、过度开采煤、石油和天然气2. 下列有关化学用语的表示正确的是( )A、CH4的球棍模型:
 B、Cl-的结构示意图:
B、Cl-的结构示意图:  C、中子数为16的硫原子:
C、中子数为16的硫原子:  D、苯的分子式:
D、苯的分子式:  3. 下列物质中,属于离子化合物的是( )A、HCl B、NH4Cl C、NO D、C6H12O6(葡萄糖)4. 下列变化,主要克服分子间作用力的是( )A、干冰升华 B、食盐熔化 C、HCl溶于水 D、硫化氢分解5. 下列互为同分异构体的是( )A、12C和14C B、甲烷和丙烷 C、O2和O3 D、正丁烷和异丁烷6. 常温下,运输浓硝酸所用容器的材料可以是( )A、Cu B、Al C、Mg D、Zn7. 下列过程中吸收热量的是( )A、甲烷的燃烧 B、浓硫酸的稀释 C、NH4Cl与Ba(OH)2·8H2O反应 D、铝热反应8. 下列物质性质与应用对应关系正确的是( )A、乙烯能发生加聚反应,可用于制塑料 B、硝酸具有酸性,可用于实验室制氢气 C、氨气易溶于水,可作制冷剂 D、蛋白质遇CuSO4溶液发生凝聚,可用于提纯蛋白质9. 下列各组离子在指定溶液中一定能大量共存的是( )A、强酸性溶液中:K+、Cu2+、NO3- B、强碱性溶液中:Na+、NH4+、Cl- C、含1 mol·L-1 NH3·H2O的溶液中:K+、Al3+、SO42- D、含1 mol·L-1 Fe3+的溶液中:H+、Na+、SCN-10. 用NA表示阿伏加德罗常数的值。下列说法正确的是( )A、2.24 L CH4中含碳原子数目是0.1 NA B、0.1 mol·L-1 NaNO3溶液中含Na+数目是0.1 NA C、1 mol Cl2与足量的铁完全反应时得到的电子数目是2 NA D、标准状况下,22.4 L苯中含分子数目是NA11. 下列关于乙烯和苯的说法正确的是( )A、常温常压下都是气体 B、都能与溴水反应 C、都能燃烧 D、都能使酸性KMnO4溶液褪色12. 下列离子方程式书写正确的是( )A、Cu(OH)2与稀硝酸反应:H++OH-= H2O B、铜片与浓硝酸反应:Cu+4H++2 NO
3. 下列物质中,属于离子化合物的是( )A、HCl B、NH4Cl C、NO D、C6H12O6(葡萄糖)4. 下列变化,主要克服分子间作用力的是( )A、干冰升华 B、食盐熔化 C、HCl溶于水 D、硫化氢分解5. 下列互为同分异构体的是( )A、12C和14C B、甲烷和丙烷 C、O2和O3 D、正丁烷和异丁烷6. 常温下,运输浓硝酸所用容器的材料可以是( )A、Cu B、Al C、Mg D、Zn7. 下列过程中吸收热量的是( )A、甲烷的燃烧 B、浓硫酸的稀释 C、NH4Cl与Ba(OH)2·8H2O反应 D、铝热反应8. 下列物质性质与应用对应关系正确的是( )A、乙烯能发生加聚反应,可用于制塑料 B、硝酸具有酸性,可用于实验室制氢气 C、氨气易溶于水,可作制冷剂 D、蛋白质遇CuSO4溶液发生凝聚,可用于提纯蛋白质9. 下列各组离子在指定溶液中一定能大量共存的是( )A、强酸性溶液中:K+、Cu2+、NO3- B、强碱性溶液中:Na+、NH4+、Cl- C、含1 mol·L-1 NH3·H2O的溶液中:K+、Al3+、SO42- D、含1 mol·L-1 Fe3+的溶液中:H+、Na+、SCN-10. 用NA表示阿伏加德罗常数的值。下列说法正确的是( )A、2.24 L CH4中含碳原子数目是0.1 NA B、0.1 mol·L-1 NaNO3溶液中含Na+数目是0.1 NA C、1 mol Cl2与足量的铁完全反应时得到的电子数目是2 NA D、标准状况下,22.4 L苯中含分子数目是NA11. 下列关于乙烯和苯的说法正确的是( )A、常温常压下都是气体 B、都能与溴水反应 C、都能燃烧 D、都能使酸性KMnO4溶液褪色12. 下列离子方程式书写正确的是( )A、Cu(OH)2与稀硝酸反应:H++OH-= H2O B、铜片与浓硝酸反应:Cu+4H++2 NO = Cu2++2NO2↑+2H2O
C、氨水与MgCl2溶液反应:Mg2+ + 2OH- = Mg(OH)2↓
D、铁与稀硝酸反应:Fe+2H+ = Fe2++H2↑
13. 下列有关性质的比较正确的是( )A、原子半径:P < S < Cl B、非金属性:P > S > Cl C、酸性:H3PO4< H2SO4 < HClO4 D、稳定性:PH3 > H2S > HCl14. 下列说法正确的是( )A、煤和石油都是可再生资源 B、可以分离煤焦油获取苯 C、煤的气化和石油的分馏都属于物理变化 D、石油的裂化仅能得到烷烃15. 一定条件下,向某容积可变的密闭容器中充入2 mol SO2和1 mol O2发生反应:2SO2+O2 2SO3。下列说法错误的是( )A、升高温度能加快化学反应速率 B、减小压强能减慢化学反应速率 C、反应生成SO3的物质的量小于2 mol D、达平衡时反应即停止16. 用氨水法脱硫并获取硫酸盐是解决SO2污染的一种方法,该过程中生成的亚硫酸盐可继续吸收SO2 , 其涉及到的化学反应有( )
= Cu2++2NO2↑+2H2O
C、氨水与MgCl2溶液反应:Mg2+ + 2OH- = Mg(OH)2↓
D、铁与稀硝酸反应:Fe+2H+ = Fe2++H2↑
13. 下列有关性质的比较正确的是( )A、原子半径:P < S < Cl B、非金属性:P > S > Cl C、酸性:H3PO4< H2SO4 < HClO4 D、稳定性:PH3 > H2S > HCl14. 下列说法正确的是( )A、煤和石油都是可再生资源 B、可以分离煤焦油获取苯 C、煤的气化和石油的分馏都属于物理变化 D、石油的裂化仅能得到烷烃15. 一定条件下,向某容积可变的密闭容器中充入2 mol SO2和1 mol O2发生反应:2SO2+O2 2SO3。下列说法错误的是( )A、升高温度能加快化学反应速率 B、减小压强能减慢化学反应速率 C、反应生成SO3的物质的量小于2 mol D、达平衡时反应即停止16. 用氨水法脱硫并获取硫酸盐是解决SO2污染的一种方法,该过程中生成的亚硫酸盐可继续吸收SO2 , 其涉及到的化学反应有( )①SO2 + 2NH3 + H2O = (NH4)2SO3 ②SO2 + NH3 + H2O = NH4HSO3
③2(NH4)2SO3 + O2 = 2(NH4)2SO4 ④2NH4HSO3 + O2 = 2NH4HSO4
A、只有① B、只有①② C、只有①③ D、全部17. 用下列装置进行实验,能达到相应实验目的的是( ) A、图1可用于吸收多余的NO B、图2可用于检验Cl2的漂白性 C、图3可用于比较Fe与Cu的金属活动性强弱 D、图4可用于测定CO2的生成速率
A、图1可用于吸收多余的NO B、图2可用于检验Cl2的漂白性 C、图3可用于比较Fe与Cu的金属活动性强弱 D、图4可用于测定CO2的生成速率二、多选题
-
18. 某原电池装置如图所示,下列说法正确的是( )
 A、Zn棒作原电池的正极 B、Cu棒的质量逐渐增大 C、Zn棒处的电极反应式:Zn - 2e- = Zn2+ D、该装置能将电能转化为化学能19. 下列各物质间的转化在给定条件下能实现的是( )A、 B、 C、 D、20. 将1.20 g铁铜合金完全溶于100 mL、12.0 mol·L-1浓硝酸中,得到NO2和N2O4混合气体672 mL(换算为标准状况下)。向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,当金属离子全部沉淀时,得到2.05 g沉淀。下列有关判断正确的是( )A、反应过程中浓硝酸仅体现氧化性 B、该合金中铁与铜物质的量之比是2:1 C、混合气体中,NO2的体积分数是1/3 D、金属离子全部沉淀时,加入NaOH溶液的体积至少为1150 mL
A、Zn棒作原电池的正极 B、Cu棒的质量逐渐增大 C、Zn棒处的电极反应式:Zn - 2e- = Zn2+ D、该装置能将电能转化为化学能19. 下列各物质间的转化在给定条件下能实现的是( )A、 B、 C、 D、20. 将1.20 g铁铜合金完全溶于100 mL、12.0 mol·L-1浓硝酸中,得到NO2和N2O4混合气体672 mL(换算为标准状况下)。向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,当金属离子全部沉淀时,得到2.05 g沉淀。下列有关判断正确的是( )A、反应过程中浓硝酸仅体现氧化性 B、该合金中铁与铜物质的量之比是2:1 C、混合气体中,NO2的体积分数是1/3 D、金属离子全部沉淀时,加入NaOH溶液的体积至少为1150 mL三、推断题
-
21. A、B、C、D、E是原子序数依次递增的短周期主族元素。其中A与E同族,A是形成有机化合物必不可少的元素,B原子的最外层电子数是其电子层数的3倍,C原子的半径在同周期中最大,D是地壳中含量最高的金属元素。回答下列问题(各物质均以具体元素符号表示):(1)、元素B在周期表中的位置是 , B和C形成的C2B的电子式是 , E形成简单氢化物的化学式是。(2)、A、B、D的原子半径从大到小的顺序是 , C和D最高价氧化物的水化物相互反应的离子方程式是。22. 下列各物质转化关系如图所示,气体A标准状况时的密度是1.25 g/L,B单质是相同条件下最轻的气体,D为黄绿色气体,F为金属单质。反应①可用于工业生产,E可用作氮肥。

回答下列问题:
(1)、A的化学式是 , C分子的结构式是。(2)、反应②的化学方程式是 ,反应③是化合反应,且G的相对分子质量为100,则F的化学式是。
23. 丙酸乙酯具有菠萝香味,用作配制朗姆酒,可通过下图进行合成(部分反应条件略去):
回答下列问题:
(1)、CH3CH2OH中官能团的名称是 , 反应②的反应类型是。(2)、反应①是加成反应,物质X的分子式是 ,有机物A的分子式是C3H5N,其结构简式是 ,
反应③的化学反应方程式为。
(3)、除去丙酸乙酯中CH3CH2COOH和CH3CH2OH的方法是:加适量的(填适宜的试剂)充分振荡、静置、分液。(4)、反应③有多种副产物,其中一种副产物M的相对分子质量为74,氧的质量分数为21.6%,n(C):n(H)=2:5,则M的分子式为。四、填空题
-
24. NH3是一种重要的化工原料,在生产、生活中用途广泛。(1)、已知:
共价键
键能/ kJ·mol-1
H-H
436
N≡N
946
N-H
391
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g) 2 NH3 (g) DH =kJ·mol-1
(2)、一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 2NH3 , 测得各组分浓度随时间变化如图1所示。
2NH3 , 测得各组分浓度随时间变化如图1所示。
①表示c(N2)的曲线是(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)mol·L-1·min-1。
③下列能说明该反应达到平衡的是。
a.混合气体的压强不再变化
b.2c(H2)=3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)、潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
①电极b名称是。
②电解质溶液中OH-离子向移动(填“电极a”或“电极b”)。
③电极a的电极反应式为。
(4)、可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是。25. 某工厂综合处理含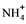 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),流程如图所示:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),流程如图所示: (1)、固体1的主要成分除Ca(OH)2外,还有、(填化学式)。(2)、为使反应①中的有关气体被充分吸收,可采取的措施有:①增大接触面积;②。(3)、已知:
(1)、固体1的主要成分除Ca(OH)2外,还有、(填化学式)。(2)、为使反应①中的有关气体被充分吸收,可采取的措施有:①增大接触面积;②。(3)、已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
为确保反应③只生成NaNO2 , 理论上应控制NO与O2的物质的量之比为;此时反应④的离子方程式为。若n(NO) :n(O2)=3:1,且NaOH溶液足量,则所得溶液1中NaNO3与NaNO2的物质的量之比为。