广西桂林市2016-2017学年高一下学期化学期末考试试卷
试卷更新日期:2018-05-03 类型:期末考试
一、单选题
-
1. 下列说法错误的是( )A、燃烧煤炭供热会加剧“温室效应" B、将废旧电池深埋处理,可有效防止电池中的重金属污染 C、预防H7N9流感病毒的措施之一是高温消毒餐具等生活日用品 D、开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济”2. 下列过程不涉及化学变化的是( )A、用铁矿石炼铁 B、用糯米酿甜酒 C、石油分馏 D、海水提溴3. 下列物质中,其主要成分属于烃的是( )A、汽油 B、油脂 C、蛋白质 D、纤维素4. 下列物质中不属于有机合成材料的是( )A、合成纤维 B、合成橡胶 C、玻璃 D、塑料5. 工业上冶炼金属镁采用的方法是( )A、热还原法 B、热氧化法 C、热分解法 D、电解法6. 下列关于20Ne和22Ne的说法正确的是( )A、20Ne和22Ne互为同位素 B、20Ne和22Ne属于同一种核素 C、20Ne和22Ne的中子数相同 D、20Ne和22Ne的质量数相同7. 在光照条件下,纳米TiO2能将甲醛催化氧化成二铖化碳和水。经10小时(h)催化氧化后,某密闭空间内甲醛的浓度从2.0×10-7mol/L降到1.0×10-7mol/L,则甲醛在这段时间内的平均反应速率为( )A、4.0×10-8mol/(L·h) B、3.0×10-8mol/(L·h) C、2.0×10-8mol/(L·h) D、1.0×10-8mol/(L·h)8. 下列物质中,只含有极性共价键的是( )A、NaCl B、O2 C、CCl4 D、NaOH9. 下列图示中的变化为吸热反应的是( )A、
 B、
B、 C、
C、 D、
D、 10. 用电子式表示下列物质的形成过程正确的是( )A、
10. 用电子式表示下列物质的形成过程正确的是( )A、 B、
B、 C、
C、 D、
D、 11. 下列物质中,能与Br2发生置换反应的是( )A、NaF B、NaCl C、KBr D、KI12. 与
11. 下列物质中,能与Br2发生置换反应的是( )A、NaF B、NaCl C、KBr D、KI12. 与 互为同分异构体的是( ) A、
互为同分异构体的是( ) A、 B、
B、 C、
C、 D、CH3—CH2—CH3
13. 下列有机物能与NaOH反应的是( )A、乙烷 B、乙醇 C、乙酸 D、苯14. 对如图所示苯的反应的描述错误的是( )
D、CH3—CH2—CH3
13. 下列有机物能与NaOH反应的是( )A、乙烷 B、乙醇 C、乙酸 D、苯14. 对如图所示苯的反应的描述错误的是( )
 A、反应①的有机产物比水重 B、反应①、③、④都属于取代反应 C、反应②的现象是火焰明亮有浓烟 D、反应④中1mol苯最多与3molH2反应15. 下列各图所示的装置,能构成原电池的是( )A、
A、反应①的有机产物比水重 B、反应①、③、④都属于取代反应 C、反应②的现象是火焰明亮有浓烟 D、反应④中1mol苯最多与3molH2反应15. 下列各图所示的装置,能构成原电池的是( )A、 B、
B、 C、
C、 D、
D、 16. 硼(B)的原子序数是5,硼的最高价氧化物的水化物的化学式不可能是( )A、HBO2 B、H3BO3 C、H2BO3 D、H4B2O517. X、Y、Z、R、W是5种短周期元素,它们的原子的最外层电子数与原子序数的关系如下图所示。下列说法正确的是( )
16. 硼(B)的原子序数是5,硼的最高价氧化物的水化物的化学式不可能是( )A、HBO2 B、H3BO3 C、H2BO3 D、H4B2O517. X、Y、Z、R、W是5种短周期元素,它们的原子的最外层电子数与原子序数的关系如下图所示。下列说法正确的是( ) A、Y和W在同一主族 B、X和R在同一周期 C、Y的最高正化合价为+7 D、Z和O2反应的产物只有一种18. 下列关于有机物实验现象与原因的叙述中,完全符合题意的一组是( )
A、Y和W在同一主族 B、X和R在同一周期 C、Y的最高正化合价为+7 D、Z和O2反应的产物只有一种18. 下列关于有机物实验现象与原因的叙述中,完全符合题意的一组是( )选项 实验现象 原因 A 乙烯和苯都能使溴水褪色 乙烯和苯都能与溴水发生加成反应 B 乙酸与NaHCO3溶液反应产生无色气体 乙酸的酸性比碳酸强 C 葡萄糖和蔗糖都能与银氨溶液共热产生银镜 葡萄糖和蔗糖都有醛基 D 乙醇和钠反应剧烈 乙醇羟基中的氢原子活泼 A、A B、B C、C D、D19. 一定温度下,某恒容密闭容器内有可逆反应:A(g)+3B(g) 2C(g),该反应进行到一定限度后达到化学平衡的标志是( )A、3v正(A)=v逆(B) B、容器内气体的质量不随时间而改变 C、容器内A,B,C三种物质的浓度相等 D、容器内A,B,C的物质的量之比为1∶3∶220. 一定量的干燥甲烷燃烧后得到49.6g CO、CO2和H2O(g)组成的气体混合物,将此气体混合物全部缓缓通过足量的浓硫酸时气体质量减少25.2g,下列说法错误的是( )A、产物中水的质量为25.2g B、参加反应的甲烷为11.2g C、产物中CO的物质的量为0.4mol D、产物中n(CO)=n(CO2)二、填空题
-
21. 如图所示,Zn、Cu与稀硫酸形成的原电池装置中,作负极,发生反应(选填“氧化”或“还原”),负极反应式为;溶液中H+向(选填“正”或“负”)极迁移。
 22. 镁带在盐酸中反成,产生H2的速率(v)与时间(t)的关系如下图所示。
22. 镁带在盐酸中反成,产生H2的速率(v)与时间(t)的关系如下图所示。 (1)、写出该反应的离子方程式。(2)、下列变化:①H+的浓度②镁带的表面积③溶液的温度④Cl-的浓度,不能影响该反应速率的有(填写选项的序号)。(3)、0~t1 , 时间段速率逐渐加快的主要原因是。(4)、t1时刻后反应速率变慢的主要原因是。23. 下表是元素周期表的一部分,请回答有关问题:
(1)、写出该反应的离子方程式。(2)、下列变化:①H+的浓度②镁带的表面积③溶液的温度④Cl-的浓度,不能影响该反应速率的有(填写选项的序号)。(3)、0~t1 , 时间段速率逐渐加快的主要原因是。(4)、t1时刻后反应速率变慢的主要原因是。23. 下表是元素周期表的一部分,请回答有关问题: (1)、①的元素符号为;⑨的原子结构示意图为 。(2)、第3周期主族元素中,原子半径最小的是(用元素符号表示)。(3)、表中元素的气态氢化物中最稳定的是(用化学式表示)。(4)、①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是(用化学式表示)。(5)、⑤、⑥两种元素相比较,金属性较强的是(填元素名称),可以验证这一结论的实验是(填符合题意选项的编号)。
(1)、①的元素符号为;⑨的原子结构示意图为 。(2)、第3周期主族元素中,原子半径最小的是(用元素符号表示)。(3)、表中元素的气态氢化物中最稳定的是(用化学式表示)。(4)、①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是(用化学式表示)。(5)、⑤、⑥两种元素相比较,金属性较强的是(填元素名称),可以验证这一结论的实验是(填符合题意选项的编号)。A.将在空气中放置已久的这两种元素的块状单质分別放入NaOH溶液中,比较反应的剧烈程度
B.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应,比较反应的剧烈程度
C.将形状,大小相同的这两种元素的单质分别和热水作用,并滴入酚酞试液,比较反应的剧烈程度
(6)、④和⑥两种元素的最高价氧化物的水化物在水溶液中反应的离子方程式为。24. 乙烯的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。(1)、乙烯的结构简式为。(2)、可以区别甲烷和乙烯的试剂是_________(填符合题意选项的编号)。A、浓硫酸 B、碳酸钠溶液 C、溴的四氯化碳溶液 D、酸性高锰酸钾溶液(3)、CH3CH3可以通过乙烯和反应生成。(4)、已知 2CH3CHO+ O2 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下所示: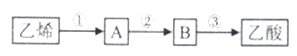
反应②的化学方程式为。
工业上以乙烯为原料生产聚乙烯的化学方程式为 , 反应类型属于。
三、实验题
-
25. 实验室用下图装置制取乙酸乙酯。请回答下列问题。
 (1)、反应开始前试管B中加入的试剂是 , 反应结束后试管B中上层液体的主要成分是。(2)、向试管A中加入试剂时,浓硫酸应在加入乙醇之后再加入,目的是。(3)、制取乙酸乙酯的化学方程式为。(4)、插入试管B中的干燥管的作用是。(5)、从试管B中分离出粗产品乙酸乙酯(含乙酸,乙醇和水),采用的分离方法是 , 使用CaO可以除去粗产品中的杂质,最后采用的方法可得到较纯净的乙酸乙酯。
(1)、反应开始前试管B中加入的试剂是 , 反应结束后试管B中上层液体的主要成分是。(2)、向试管A中加入试剂时,浓硫酸应在加入乙醇之后再加入,目的是。(3)、制取乙酸乙酯的化学方程式为。(4)、插入试管B中的干燥管的作用是。(5)、从试管B中分离出粗产品乙酸乙酯(含乙酸,乙醇和水),采用的分离方法是 , 使用CaO可以除去粗产品中的杂质,最后采用的方法可得到较纯净的乙酸乙酯。四、解答题
-
26. 将金属钙置于空气中充分燃烧,然后向所得固体产物中加入一定量蒸馏水,观察到剧烈反应,产生大量的热,并且放出有臭味的气体。对此,化学兴趣小组的同学们在老师的指导下进行了探究。
【査阅资料】①Mg在氮气中燃烧生成氮化镁(Mg3N2),氮化镁与水发生复分解反应,有NH3生成。
②CaO2遇水反应生成H2O2 , H2O2会分解产生一定量的O3。
③碘量法是最常用的臭氧测定方法,其原理为:O3+2KI+H2O=O2+I2+2K0H(1)、甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性,因此可以推断Ca在空气燃烧时,能与空气中的氮气反应生成。(2)、乙同学提出:Ca的性质比Na活泼,在空气中燃烧也有CaO2生成,其化学方程式为:。(3)、丙同学对臭味气体的成分提出三种假设。【提出假设】假设1:产生臭味的气体只是O3;
假设2:产生臭味的气体只是;
假设3:产生臭味的气体是。
(4)、【实验探究】为此,同学们对臭味气体的成分进行了实验探究。实验室提供的实验试剂有:红色石蕊试纸、蓝色石蕊试纸、淀粉-KI试纸、蒸馏水。请按下列表格填写完成实验操作、与结论相应的预期现象:
实验操作
预期现象
结论
取少量钙在空气中充分燃烧后的 固体产物于试管中,加少量蒸熘水,分别用、在短时间内快速检测产生的气体。
假设1成立
假设2成立
假设3成立
五、计算题
-
27. 取A克铝粉和Fe2O3粉末组成的铝热剂,在隔绝空气的条件下加热使之充分反应。将反应后所得混合物研细,加入足量的氢氧化钠溶液,反应完全后放出气体0.672L;另取A克相同的铝热剂与足量稀硫酸作用,反应产生3.36L气体(上述气体体积均已换算成标准状况)。(1)、A克铝热剂中铝的物质的量为mol。(2)、A克铝热剂发中铝热反应,生成铁的质量为g。(3)、计算该铝热剂中铝粉的质量分数(结果准确到0.1%)。
-
-