2016-2017学年山东省枣庄市滕州市高三上学期期中化学试卷(五)
试卷更新日期:2016-12-14 类型:期中考试
一、选择题
-
1. 化学与科学、技术、社会、环境密切相关.下列有关说法中正确的是( )A、明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 B、变质的植物油有难闻的特殊气味,是由于植物油发生了酯化反应 C、浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 D、海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化2. 设NA为阿伏加德罗常数值.下列有关叙述正确的是( )A、14 g乙烯和丙烯混合气体中的氢原子数为2NA B、1 molN2与4 mol H2反应生成的NH3分子数为2NA C、1 molFe溶于过量硝酸,电子转移数为2NA D、标准状况下,2.24 LCCl4含有的共价键数为0.4NA3. 下列指定反应的离子方程式正确的是( )A、将铜插入稀硝酸中:Cu+4H++2NO3﹣═Cu2++2NO2↑+H2O B、向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ C、向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ D、向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+3H+═H2SiO3↓+3Na+4. 对于反应:3BrF3+5H2O=Br2+HBrO3+O2+9HF,下列说法正确的是( )A、该反应中,有三种元素化合价发生改变 B、该反应的氧化剂为BrF3 , 氧化产物为O2 C、1.5molBrF3参加反应,有4mole一转移 D、1.5molH2O参加反应,被H2O还原的BrF3为0.4mol5. 已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO﹣+4OH﹣═2RO4n﹣+3Cl﹣+5H2O,则RO4n﹣中R的化合价是( )A、+3 B、+4 C、+5 D、+66. 已知:2H2(g)+O2(g)═2H2O(l)
△H=﹣571.6kJ•mol﹣1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)
△H=﹣1 452kJ•mol﹣1
H+(aq)+OH﹣(aq)═H2O(l)
△H=﹣57.3kJ•mol﹣1
下列说法正确的是( )
A、H2(g)的燃烧热为571.6 kJ•mol﹣1 B、 H2SO4(aq)+ Ba(OH)2(aq)═ BaSO4(s)+H2O(l)△H=﹣57.3 kJ•mol﹣1 C、同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 D、3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol﹣17. 下列关于元素的叙述正确的是( )A、目前使用的元素周期表中,最长的周期含有36种元素 B、只有在原子中,质子数才与核外电子数相等 C、金属元素与非金属元素能形成共价化合物 D、非金属元素形成的共价化合物中,原子的最外层电子数只能是2或88. 短周期元素R,W,X,Y,Z的原子序数依次增大,R原子的最外层电子数是其内层电子数的2倍,X 元素的焰色反应呈黄色,W元素和Z元素同主族,且Z元素的核电荷数是W的2倍,Y是地壳中除氧外含量最多的非金属元素.下列说法不正确的是( )A、W与X形成的两种化合物中阴、阳离子的个数比均为1:2 B、Y,R,Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y C、W的简单氢化物稳定性比Z的简单氢化物稳定性低 D、Y与W形成的化合物YW2的熔点高、硬度大9. 只改变一个影响因素,平衡常数K与平衡移动的关系叙述不正确的是( )A、K值不变,平衡可能移动 B、平衡向右移动时,K值不一定移动 C、K值有变化,平衡一定移动 D、相同条件下,同一个反应的方程式的化学计量数增大2倍,K值也增大两倍10. 少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体
⑤加NaCl溶液⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10mL 0.1mol/L盐酸.
A、①⑥⑦ B、③⑤⑧ C、③⑦⑧ D、⑤⑦⑧11. 25℃时,在氢氧化镁悬浊液中存在沉淀溶解平衡:Mg(OH)2(s)═Mg2+(q)+2OH﹣(aq),已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11 , Ksp[Cu(OH)2]=2.2×10﹣20 . 下列说法错误的是( )A、若向Mg(OH)2浊液中加入少量NH4Cl(s),c(Mg2+)会增大 B、若向Mg(OH)2浊液中滴加CuSO4溶液,沉淀将由白色逐渐变为蓝色 C、若向Mg(OH)2浊液中加入适量蒸馏水,Ksp保持不变,故上述平衡不发生移动 D、若向Mg(OH)2浊液中加入少量Na2CO3(s),固体质量将增大12. 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生且溶液不变蓝,下列叙述正确的是( ) A、铜电极上发生还原反应 B、石墨电极附近溶液呈红色 C、溶液中的Na+向石墨电极移动 D、铜电极附近观察到黄绿色气体13. 下列有关物质的性质或应用均正确的是( )A、Si是一种非金属主族元素,其氧化物可用于制作计算机芯片 B、氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂 C、铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水 D、用二氧化硫加工银耳,使之更白14. 下列物质依次按照混合物、氧化物、弱电解质和非电解质的顺序排列的一组是( )A、淀粉、CuO,HClO、Cu B、普通玻璃、H2O、Fe(SCN)3、葡萄糖 C、KAl(SO4)2•12H2O,KClO3、NH3•H2O,CH3CH2OH D、水玻璃、Na2O•CaO•6SiO2、Ag2O,SO315. 甲、乙两烧杯中各盛有100mL 1.5mol/L的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后生成气体的体积比为甲:乙=1:2,则加入铝粉的质量为( )A、1.8g B、3.6g C、2.7g D、5.4g16. 下列叙述错误的是( )A、10mL质量分数为98%的H2SO4 , 用10mL水稀释后,H2SO4的质量分数大于49% B、配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶 C、在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 D、向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变)17. 常温下pH=a的CH3COOH稀溶液与pH=b的NaOH稀溶液等体积混合,下列判断正确的是( )A、反应过程中,CH3COOH的电离程度增大 B、若混合后pH=7,则a+b=14 C、若混合后pH=5.3,则c(Na+)<c( CH3COO﹣) D、若混合后CH3COOH与NaOH恰好完全反应,则a+b<1418. 在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g)△H1
A、铜电极上发生还原反应 B、石墨电极附近溶液呈红色 C、溶液中的Na+向石墨电极移动 D、铜电极附近观察到黄绿色气体13. 下列有关物质的性质或应用均正确的是( )A、Si是一种非金属主族元素,其氧化物可用于制作计算机芯片 B、氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂 C、铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水 D、用二氧化硫加工银耳,使之更白14. 下列物质依次按照混合物、氧化物、弱电解质和非电解质的顺序排列的一组是( )A、淀粉、CuO,HClO、Cu B、普通玻璃、H2O、Fe(SCN)3、葡萄糖 C、KAl(SO4)2•12H2O,KClO3、NH3•H2O,CH3CH2OH D、水玻璃、Na2O•CaO•6SiO2、Ag2O,SO315. 甲、乙两烧杯中各盛有100mL 1.5mol/L的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后生成气体的体积比为甲:乙=1:2,则加入铝粉的质量为( )A、1.8g B、3.6g C、2.7g D、5.4g16. 下列叙述错误的是( )A、10mL质量分数为98%的H2SO4 , 用10mL水稀释后,H2SO4的质量分数大于49% B、配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶 C、在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 D、向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变)17. 常温下pH=a的CH3COOH稀溶液与pH=b的NaOH稀溶液等体积混合,下列判断正确的是( )A、反应过程中,CH3COOH的电离程度增大 B、若混合后pH=7,则a+b=14 C、若混合后pH=5.3,则c(Na+)<c( CH3COO﹣) D、若混合后CH3COOH与NaOH恰好完全反应,则a+b<1418. 在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g)△H1Cl2(g)+H2(g)=2HCl(g )△H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
A、△H3=△H1+2△H2 B、△H3=△H1+△H2 C、△H3=△H1﹣2△H2 D、△H3=△H1﹣△H219. 一定条件下,对于可逆反应X(g)+3Y(g)⇌2Z(g),若X,Y,Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X,Y,Z的浓度分别为0.1mol•L﹣1、0.3mol•L﹣1、0.08mol•L﹣1 , 则下列判断正确的是( )A、c1:c2=3:1 B、平衡时,Y和Z的生成速率之比为2:3 C、X,Y的转化率不相等 D、c1的取值范围为0 mol•L﹣1<c1<0.14 mol•L﹣120. 常温常压下,将盛有20mL NO2和O2的混合气体的大试管倒立在水槽中,水面上升至一定位置后不再变化,此时还有3mL气体,则原混合气体中的NO2的体积可能是( )A、17.8 mL B、14.8 mL C、12.6 mL D、12.4 mL21. 25℃和101kPa时,乙烷、乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合径中乙炔的体积分数为( )A、12.5% B、25% C、50% D、75%22. 青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不考虑立体异构)( ) A、6种 B、7种 C、8种 D、9种23. 只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )A、NaOH B、H2SO4 C、BaCl2 D、AgNO324. 已知A,B,D,E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
A、6种 B、7种 C、8种 D、9种23. 只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )A、NaOH B、H2SO4 C、BaCl2 D、AgNO324. 已知A,B,D,E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( ) A、若A是铁,则E可能为稀硝酸 B、若A是CuO,E是碳,则B为CO C、若A是NaOH溶液,E是CO2 , 则B为NaHCO3 D、若A是AlCl3溶液,E可能是氨水
A、若A是铁,则E可能为稀硝酸 B、若A是CuO,E是碳,则B为CO C、若A是NaOH溶液,E是CO2 , 则B为NaHCO3 D、若A是AlCl3溶液,E可能是氨水二、解答题
-
25. 聚合硫酸铁(PFS)是水处理中重要的絮凝剂,如图是以回收废铁屑为原料制备PFS的一种工艺流程.

回答下列问题
(1)、废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为 . 粉碎过筛的目的是 .(2)、酸浸时最合适的酸是 , 写出铁锈与酸反应的离子方程式 .(3)、反应釜中加入氧化剂的作用是 , 下列氧化剂中最合适的是(填标号).A.KMnO4 B.Cl2 C.H2O2 D.HNO3
(4)、聚合釜中溶液的pH必须控制在一定的范围内,pH偏小时Fe3+水解程度弱,pH偏大时则 .(5)、相对于常压蒸发,减压蒸发的优点是 .(6)、盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为B= (n为物质的量).为测量样品的B值,取样品m g,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c mol•L﹣1的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰).到终点时消耗NaOH溶液V mL.按上述步骤做空白对照试验,消耗NaOH溶液V0 mL,已知该样品中Fe的质量分数w,则B的表达式为 .26. 丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:(1)、以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:C3H6(g)+NH3(g)+ O2(g)=C3H3N(g)+3H2O(g)△H=﹣515kJ/mol
C3H6(g)+O2(g)=C3H4O(g)+H2O(g)△H=﹣353kJ/mol
两个反应在热力学上趋势均很大,其原因是;有利于提高丙烯腈平衡产率的反应条件是;提高丙烯腈反应选择性的关键因素是 .
(2)、图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃.低于460℃时,丙烯腈的产率(填“是”或者“不是”)对应温度下的平衡产率,判断理由是;高于460℃时,丙烯腈产率降低的可能原因是(双选,填标号)
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大
 (3)、丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示.由图可知,最佳n(氨)/n(丙烯)约为 , 理由是 . 进料气氨、空气、丙烯的理论体积比约为27. 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:(1)、基态Ge原子的核外电子排布式为[Ar] , 有个未成对电子.(2)、Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是 .(3)、比较下列锗卤化物的熔点和沸点,分析其变化规律及原因
(3)、丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示.由图可知,最佳n(氨)/n(丙烯)约为 , 理由是 . 进料气氨、空气、丙烯的理论体积比约为27. 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:(1)、基态Ge原子的核外电子排布式为[Ar] , 有个未成对电子.(2)、Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是 .(3)、比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4
GeBr4
GeI4
熔点/℃
﹣49.5
26
146
沸点/℃
83.1
186
约400
(4)、光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂.Zn、Ge、O电负性由大至小的顺序是 .(5)、Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为 , 微粒之间存在的作用力是 .(6)、晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0, ),C为( , ,0).则D原子的坐标参数为 .
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为 g•cm﹣3(列出计算式即可).
 28. 焦亚硫酸钠(Na2S2O5)是一种食品添加剂.实验室用如图1所示装置制备Na2S2O5 , 实验步骤如下:
28. 焦亚硫酸钠(Na2S2O5)是一种食品添加剂.实验室用如图1所示装置制备Na2S2O5 , 实验步骤如下:
Ⅰ.在Na2CO3溶液中通入SO2至pH为4.1,生成NaHSO3溶液;
Ⅱ.加碳酸钠粉末调至pH为7~8;
Ⅲ.再通SO2至pH为4.1;
Ⅳ.从过饱和溶液中析出Na2S2O5晶体.
(1)、制备焦亚硫酸钠总反应的化学方程式为 .(2)、Na2S2O5溶于水且与水能反应,所得溶液显酸性,其原因是 . 步骤Ⅲ中测定溶液的pH的方法是;pH>4.1时,则产品中会有副产物,其化学式是 .(3)、利用碘量法可测定Na2S2O5产品中+4价硫的含量,实验方案为:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中, , 重复如上步骤2次,记录数据.(实验中必须使用的试剂有:c1mol•L﹣1的标准碘溶液、c2mol•L﹣1的标准Na2S2O3溶液、冰醋酸、淀粉溶液、蒸馏水;已知:2Na2S2O3+I2═Na2S4O6+2NaI)(4)、含铬废水中常含有六价铬[Cr(Ⅵ)].利用Na2S2O5和FeSO4•7H2O先后分两个阶段处理含Cr2O72﹣的废水,实验结果见右图.①实验过程中溶液的pH不断升高的原因是 .
②已知:Ksp[Cr(OH)3]=6.4×10﹣31 , lg2≈0.3,c(Cr3+)<1.0×10﹣5 mol•L﹣1时视为完全沉淀.现将废水中Cr2O72﹣全部转化为Cr(OH)3而除去,需调节溶液的pH范围为 .
29. 醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂,实验室中以锌粒,三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒,已知二价铬不稳定,极易被氧气氧化,不与锌反应.制备过程中发生的相关反应如下:Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
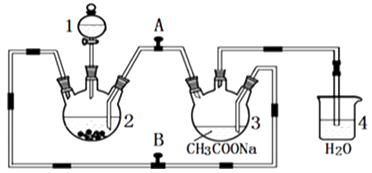
请回答下列问题:
(1)、仪器1的名称是 .(2)、往仪器2中加盐酸和三氯化铬溶液的顺序最好是(选下面的A、B或C);目的是 .A.盐酸和三氯化铬溶液同时加入 B.先加三氯化铬溶液一段时间后再加盐酸C.先加盐酸一段时间后再加三氯化铬溶液
(3)、为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门(填“A”或“B”,下同),打开阀门 .(4)、本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是 .(5)、已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O9.4g,则该实验所得产品的产率为(不考虑溶解的醋酸亚铬水合物).(6)、铬的离子会污染水,常温下要除去上述实验中多余的Cr2+ , 最好往废液中通入足量的,再加入碱液,调节pH至少为才能使铬的离子沉淀完全(铬的离子浓度应小于10﹣5mol/L).【已知Cr(OH)3的溶度积为6.3×10﹣31 , ≈4,lg2≈0.3】