2016-2017学年河南省洛阳市高三上学期期中化学试卷
试卷更新日期:2016-12-14 类型:期中考试
一、解答题
-
1. 下列叙述正确的是( )A、氢氧化铝、碳酸钠都是常见的胃酸中和剂 B、长期摄入肉、蛋、鱼偏多易导致血液偏酸性 C、碘酒中的碘因有还原性而起到杀菌消毒作用 D、碘盐、铁强化酱油等营养强化剂适合所有人食用2. 下列说法不正确的是( )A、仅用酸性高锰酸钾溶液可区分苯和甲苯 B、仅用氯化铁溶液可区分苯酚稀溶液和甘油 C、仅用硝酸和硝酸银溶液可验证卤代烃中卤原子的种类 D、仅用溴的四氯化碳溶液可区别液态的植物油和动物油3. 化学与社会、生活密切相关.对下列现象或事实的解释正确的是( )
选项
现象或事实
解释
A
用热的烧碱溶液洗去镀件油污
Na2CO3可直接和油污反应
B
漂白粉在空气中久置变质
漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
C
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
K2CO3与NH4Cl溶液反应生成氨气会降低氨肥肥效
D
FeCl3溶液可用于铜质印刷线路板制作
FeCl3能从含有Cu2+的溶液中置换出铜
A、A B、B C、C D、D4. 下列关于如图所示电化学装置的分析正确的是( ) A、若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜 B、若X为直流电源,Y为碳棒接负极,则Fe棒被保护 C、若X为电流计,Y为锌棒,则SO42﹣ 移向Fe棒 D、若X为导线,Y为铜棒,则Fe棒发生还原反应5. 若往20mL 0.01mol•L﹣l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( )
A、若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜 B、若X为直流电源,Y为碳棒接负极,则Fe棒被保护 C、若X为电流计,Y为锌棒,则SO42﹣ 移向Fe棒 D、若X为导线,Y为铜棒,则Fe棒发生还原反应5. 若往20mL 0.01mol•L﹣l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示,下列有关说法不正确的是( ) A、HNO2的电离平衡常数:c点>b点 B、b点混合溶液显酸性:c(Na+)>c(NO2﹣)>c(H+)>c(OH﹣) C、c点混合溶液中:c(OH﹣)>c(HNO2) D、d点混合溶液中:c(Na+)>c(OH﹣)>c(NO2﹣)>c(H+)6. 下列化合物的俗称与化学式不一致的是( )A、绿矾一FeSO4•7H2O B、芒硝一Na2SO4•10H2O C、明矾一Al(SO4)3•12H2O D、胆矾一CuSO4•5H2O7. 火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2下列说法正确的是( )A、SO2既是氧化产物又是还原产物 B、CuFeS2仅作还原剂,硫元素被氧化 C、每生成1mol Cu2S,有4 mol硫被氧化 D、每转移1.2 mol电子,有0.3 mol硫被氧化8. 能正确表示下列反应的离子方程式为( )A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ B、NH4HCO3溶于过量的NaOH溶液中:HCO3﹣+OH﹣=CO32﹣+H2O C、少量SO2通入苯酚钠溶液中:C6H5O﹣+SO2+H2O=C6H5OH+HSO3﹣ D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO﹣+CO2↑+H2O9. 设 NA为阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5 NA B、常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为 NA C、50 mL 18.4 mol•L﹣1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46 NA D、密闭容器盛有0.1 mol N2和0.3 mol H2 , 在一定条件下充分反应,转移电子的数目为0.6 NA10. 有关NaHCO3与Na2CO3的性质,下列叙述中不正确的是( )A、Na2CO3和NaHCO3粉末与同浓度的盐酸时,Na2CO3因为碱性强,所以与盐酸反应放出气体速度快 B、等物质的量的两种盐与同浓度的盐酸反应,Na2CO3所消耗盐酸的体积是 NaHCO3的两倍 C、向Na2CO3饱和溶液中通入过量CO2 , 有NaHCO3结晶析出 D、Na2CO3和NaHCO3溶液分别和BaCl2溶液反应,现象不同11. 1L某混合溶液中,溶质X,Y的浓度都为0.1mol•L﹣1 , 向混合溶液中滴加某溶液Z(0.1mol•L﹣1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X,Y,Z分别是( )
A、HNO2的电离平衡常数:c点>b点 B、b点混合溶液显酸性:c(Na+)>c(NO2﹣)>c(H+)>c(OH﹣) C、c点混合溶液中:c(OH﹣)>c(HNO2) D、d点混合溶液中:c(Na+)>c(OH﹣)>c(NO2﹣)>c(H+)6. 下列化合物的俗称与化学式不一致的是( )A、绿矾一FeSO4•7H2O B、芒硝一Na2SO4•10H2O C、明矾一Al(SO4)3•12H2O D、胆矾一CuSO4•5H2O7. 火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2下列说法正确的是( )A、SO2既是氧化产物又是还原产物 B、CuFeS2仅作还原剂,硫元素被氧化 C、每生成1mol Cu2S,有4 mol硫被氧化 D、每转移1.2 mol电子,有0.3 mol硫被氧化8. 能正确表示下列反应的离子方程式为( )A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ B、NH4HCO3溶于过量的NaOH溶液中:HCO3﹣+OH﹣=CO32﹣+H2O C、少量SO2通入苯酚钠溶液中:C6H5O﹣+SO2+H2O=C6H5OH+HSO3﹣ D、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO﹣+CO2↑+H2O9. 设 NA为阿伏加德罗常数的值,下列叙述正确的是( )A、标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5 NA B、常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为 NA C、50 mL 18.4 mol•L﹣1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46 NA D、密闭容器盛有0.1 mol N2和0.3 mol H2 , 在一定条件下充分反应,转移电子的数目为0.6 NA10. 有关NaHCO3与Na2CO3的性质,下列叙述中不正确的是( )A、Na2CO3和NaHCO3粉末与同浓度的盐酸时,Na2CO3因为碱性强,所以与盐酸反应放出气体速度快 B、等物质的量的两种盐与同浓度的盐酸反应,Na2CO3所消耗盐酸的体积是 NaHCO3的两倍 C、向Na2CO3饱和溶液中通入过量CO2 , 有NaHCO3结晶析出 D、Na2CO3和NaHCO3溶液分别和BaCl2溶液反应,现象不同11. 1L某混合溶液中,溶质X,Y的浓度都为0.1mol•L﹣1 , 向混合溶液中滴加某溶液Z(0.1mol•L﹣1氢氧化钠或硫酸溶液)至溶液呈中性,所得沉淀的物质的量如图所示,则X,Y,Z分别是( ) A、氯化铝、氯化铁、氢氧化钠 B、氯化铝、氯化镁、氢氧化钠 C、偏铝酸钠、氢氧化钡、硫酸 D、偏铝酸钠、氯化钡、硫酸12. 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L﹣1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( )
A、氯化铝、氯化铁、氢氧化钠 B、氯化铝、氯化镁、氢氧化钠 C、偏铝酸钠、氢氧化钡、硫酸 D、偏铝酸钠、氯化钡、硫酸12. 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01mol•L﹣1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( ) A、原子半径的大小W<X<Y B、元素的非金属性Z>X>Y C、Y的氢化物常温常压下为液态 D、X的最高价氧化物的水化物为强酸13. 已知:Fe2O3(s)+C(s)═CO2(g)+2Fe(s)△H=+234.1kJ•mol﹣1
A、原子半径的大小W<X<Y B、元素的非金属性Z>X>Y C、Y的氢化物常温常压下为液态 D、X的最高价氧化物的水化物为强酸13. 已知:Fe2O3(s)+C(s)═CO2(g)+2Fe(s)△H=+234.1kJ•mol﹣1C(s)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1
则2Fe(s)+O2(g)═Fe2O3(s)的△H是( )
A、﹣824.4 kJ•mol﹣1 B、﹣627.6kJ•mol﹣1 C、﹣744.7kJ•mol﹣1 D、﹣168.4kJ•mol﹣114. 金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )A、阳极发生还原反应,其电极反应式:Ni2++2e﹣═Ni B、电解过程中,阳极质量的减少与阴极质量的增加相等 C、电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D、电解后,电解槽底部的阳极泥中只有Cu和Pt15. 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( ) A、该装置将化学能转化为光能和电能 B、该装置工作时,H+从b极区向a极区迁移 C、每生成1mol O2 , 有44g CO2被还原 D、a电极的反应为:3CO2+18H+﹣18e﹣=C3H8O+5H2O16. 将 4mol A 气体和 2mol B 气体在 2L 的容器中混合并在一定条件下发生如下反应:
A、该装置将化学能转化为光能和电能 B、该装置工作时,H+从b极区向a极区迁移 C、每生成1mol O2 , 有44g CO2被还原 D、a电极的反应为:3CO2+18H+﹣18e﹣=C3H8O+5H2O16. 将 4mol A 气体和 2mol B 气体在 2L 的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)⇌3C(g)+4D(s),若经 2s后测得 C 的浓度为 0.9mol•L﹣1 , 现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3mol•L﹣1•s﹣1
②用物质 D 表示的反应的平均速率为 0.6mol•L﹣1•s﹣1
③2s 时物质 A 的转化率为30%
④用A、B、C来表示反应速率,其速率之比=2:1:3
其中正确的是( )
A、①③④ B、①②③④ C、①②③ D、③④17. 40℃时,在氨﹣水体系中不断通入CO2 , 各种离子的变化趋势如图所示.下列说法不正确的是( ) A、在pH=9.0时,c(NH4+)>c(HCO3﹣)>c(NH2COO﹣)>c(CO32﹣) B、不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32﹣)+c(HCO3﹣)+c(NH2COO﹣)+c(OH﹣) C、随着CO2的通入, 不断增大 D、在溶液pH不断降低的过程中,有含NH2COO﹣的中间产物生成18. 常温时向20mL 0.1mol•L﹣1 HA溶液中不断滴入0.1mol•L﹣1 NaOH溶液,pH变化如图.下列叙述正确的是( )
A、在pH=9.0时,c(NH4+)>c(HCO3﹣)>c(NH2COO﹣)>c(CO32﹣) B、不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32﹣)+c(HCO3﹣)+c(NH2COO﹣)+c(OH﹣) C、随着CO2的通入, 不断增大 D、在溶液pH不断降低的过程中,有含NH2COO﹣的中间产物生成18. 常温时向20mL 0.1mol•L﹣1 HA溶液中不断滴入0.1mol•L﹣1 NaOH溶液,pH变化如图.下列叙述正确的是( ) A、HA的电离方程式:HA═H++A﹣ B、水的电离程度:a点>b点 C、c点溶液:c(H+)+c(Na+)═c(A﹣)+c(HA) D、d点溶液:c(Na+)>c(A﹣)>c(OH﹣)>c(H+)19. 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
A、HA的电离方程式:HA═H++A﹣ B、水的电离程度:a点>b点 C、c点溶液:c(H+)+c(Na+)═c(A﹣)+c(HA) D、d点溶液:c(Na+)>c(A﹣)>c(OH﹣)>c(H+)19. 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )提示BaSO4(s)⇌Ba2+(aq)+SO42﹣(aq)的平衡常数Ksp=[Ba2+]•[SO42﹣],称为溶度积常数.
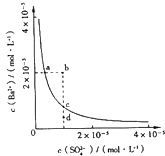 A、加入Na2SO4可以使溶液由a点变到b点 B、通过蒸发可以使溶液由d点变到c点 C、d点无BaSO4沉淀生成 D、a点对应的Ksp大于c点对应的Ksp20. 室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
A、加入Na2SO4可以使溶液由a点变到b点 B、通过蒸发可以使溶液由d点变到c点 C、d点无BaSO4沉淀生成 D、a点对应的Ksp大于c点对应的Ksp20. 室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:实验编号
起始浓度/(mol•L﹣1)
反应后溶液的pH
c(HA)
c(KOH)
①
0.1
0.1
9
②
x
0.2
7
下列判断不正确的是( )
A、实验①反应后的溶液中:c(K+)>c(A﹣)>c(OH﹣)>c(H+) B、实验①反应后的溶液中:c(OH﹣)=c(K+)﹣c(A﹣)= mol/L C、实验②反应后的溶液中:c(A﹣)+c(HA)>0.1 mol/L D、实验②反应后的溶液中:c(K+)=c(A﹣)>c(OH﹣)=c(H+)二、解答题
-
21. 某实验小组利用如图装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式.
 (1)、按图连接好实验装置,检查装置的气密性,方法是 .(2)、反应过程中末端导管必须始终插入试管A的水中,目的是 .(3)、制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应; ③反应结束后,;④拆除装置,取出产物.(4)、上述步骤①中通入N2﹣段时间后再点燃酒精灯原因是 , 装置中干燥管后的U形管的作用是 .(5)、数据记录如表:
(1)、按图连接好实验装置,检查装置的气密性,方法是 .(2)、反应过程中末端导管必须始终插入试管A的水中,目的是 .(3)、制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应; ③反应结束后,;④拆除装置,取出产物.(4)、上述步骤①中通入N2﹣段时间后再点燃酒精灯原因是 , 装置中干燥管后的U形管的作用是 .(5)、数据记录如表:空瓷舟质量m0/g
瓷舟与钙的质量m1/g
瓷舟与产物的质量m2/g
14.80
15.08
15.15
①计算得到实验式CaxN2 , 其中x= .
②若通入的N2中混有少量O2 , 请比较x与3的大小,并给出判断依据: .
22. 研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:(1)、甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂.该实验(填“能”或“不能”)达到目的,原因是 . (2)、为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,
(2)、为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2 , 测量所得气体体积,数据如下:
MnO2的质量/g
0.1
0.2
0.4
40s末O2体积/mL
49
61
86
由此得出的结论是 , 原因是 .
(3)、为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL 5% H2O2 ):试管
Ⅰ
Ⅱ
Ⅲ
滴加试剂
5滴0.1mol•L﹣1FeCl3
5滴0.1mol•L﹣1 CuCl2
5滴0.3mol•L﹣1 NaCl
产生气泡情况
较快产生细小气泡
缓慢产生细小气泡
无气泡产生
结论是 , 实验Ⅲ的目的是 .
(4)、①查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是和(按反应发生的顺序写).
②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为H2O2分解反应的催化剂需要满足的条件是 .
23. 硅单质及其化合物应用范围很广.请回答下列问题(1)、制备硅半导体材料必须先得到高纯硅的主要方法,其生产过程示意图如图所示.
①写出由纯SiHCl3制备高纯硅的化学反应方程式
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式,H2还原SiHCl3过程中若混入O2 , 可能引起的后果是 .
(2)、硅酸钠水溶液俗称水玻璃.取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡.写出实验现象其产生原因: .①2O2(g)+N2(g)=N2O4 , (l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3
④2N2 H4 (1)+N2O4 (1)=3N2 (g)+4H2O(g)△H4=﹣1048.9kJ/mol
上述反应热效应之间的关系式为△H4= , 联氨和N2O4可作为火箭助推剂,折算在标准状况下的数据,燃爆后气体的体积与燃爆前的体积之比为:
N2H4
N2O4
密度/g/cm3
1.004
1.44
(3)、联氨为二元弱減,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为(已知:N2H4+H+⇌N2H5+的K=8.7×107;KW=1.0×10﹣14),.联氨与硫酸形成的酸式盐的化学式为 .(4)、联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 . 联氨可用于处理锅炉水中的氧;防止锅炉被腐蚀,理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 .