2015-2016学年新人教版九年级下学期期末化学试卷(3)
试卷更新日期:2016-12-12 类型:期末考试
一、选择题
-
1. 下列食品、调味品的制作过程中,没有发生化学变化的是( )A、鲜奶制酸奶 B、糯米酿甜酒 C、水果榨果汁 D、黄豆酿酱油2. 下列各组物质中,一定都含有氧元素的是( )A、碱、金属氧化物 B、盐、非金属氧化物 C、盐、金属氧化物 D、酸、非金属氧化物3. 鱼胆弄破后会使鱼肉粘上难溶于水的胆汁酸(一种酸)而变苦,要减少这种苦味.用来洗涤的最佳物质是( )A、水 B、纯碱 C、食盐 D、食醋4. 某物质R是人类生命活动中不可缺少的物质.已知R的相对分子质量为150,其中含碳元素40%,含氢元素6.7%,其余为氧元素.则R的化学式为( )A、C5H10O2 B、C5H10O5 C、C6H6O D、C6H12O65. 有20℃等质量的两份饱和石灰水,一份冷却到10℃;另一份加入少量生石灰后,温度仍保持20℃.这两种情况下都不改变的量是( )A、Ca(OH)2的溶解度 B、溶剂的质量 C、溶液的质量 D、溶液中溶质的质量分数6. 下列离子能在pH=2的无色溶液中大量共存的是( )A、SO42﹣、Fe3+、Na+、OH﹣ B、K+、SO42﹣、Cu2+、NO3﹣ C、Cl﹣、K+、SO42﹣、Na+ D、Ca2+、Cl﹣、CO32﹣、Na+7. 有一组物质:氧化铜、五氧化二磷、水,分析把它们放一在组内的理由,然后从以下选项中找出与它们是同一类别的物质( )A、铜 B、氧化镁 C、磷 D、石灰水8. 下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )A、2Na2O2+2H2O=4NaOH+O2↑ B、C+H2O CO+H2 C、Cl2+H2O=HCl+HClO D、2F2+2H2O=4HF+O29. 下列图象能正确反映对应变化关系的是( )




A、用酒精灯加热一定质量的高锰酸钾固体
B、将等质量的镁片和铁片投入到足量的稀硫酸中
C、用等质量、等质量分数的双氧水分别制取氧气
D、将水通电电解一段时间
A、A B、B C、C D、D10. 下列物质露置在空气中一段时间后,质量不会发生变化的是( )A、生石灰 B、氯化钠 C、浓硫酸 D、浓盐酸11. 下列物质的化学名称与俗名,对应错误的是( )A、汞﹣﹣水银 B、氧化钙﹣﹣熟石灰、消石灰 C、碳酸氢钠﹣﹣小苏打 D、氢氧化钠﹣﹣烧碱、火碱、苛性钠12. 有四瓶失去标签的溶液,它们分别是①Ba(OH)2溶液②K2SO4溶液③KCl溶液④FeCl3溶液,不用其它任何试剂将它们鉴别开来的合理顺序是( )A、④①②③ B、②③①④ C、④②①③ D、③②④①13. 下列各组溶液中不用其他试剂,仅用组内物质相互反应就能区别开来的是( )A、NaOH,CuSO4 , MgCl2 B、Na2SO4 , BaCl2 , Na2CO3 C、KNO3 , CuSO4 , NaCl D、NaNO3 , BaCl2 , KCl14. 除去下列物质中混有的少量杂质,所选用的试剂及操作方法不正确的是( )序号
物质
杂质(少量)
试剂和操作方法
A
O2
H2O蒸汽
通过浓H2SO4
B
稀盐酸
稀硫酸
加入适量BaCl2溶液,过滤
C
Na2CO3粉末
NaHCO3粉末
加热
D
KNO3溶液
Ba(NO3)2溶液
加入适量的Na2SO4溶液,过滤
A、A B、B C、C D、D15. 将铁片分别投入下列溶液中,溶液的质量会减少的是( )A、硫酸铜 B、稀硫酸 C、硫酸亚铁 D、稀盐酸16. 下列反应中有一种物质既是氧化剂又是还原剂的是( )A、2KI+Br2=2KBr+I2 B、2AgNO3 2Ag+2NO2↑+O2↑ C、Cu2(OH)2CO3 2CuO+CO2↑+H2O D、2Na2O2+2H2O=4NaOH+O2↑17. 硅的元素符号为Si,单晶硅是制作电子集成电路的基础材料.用化学方法可制得高纯硅,有关化学反应方程式为:①SiO2+2C Si+2CO↑ ②Si+2Cl2 SiCl4 ③SiCl4+2H2 Si+4HCl.上述反应③的反应类型属于( )
A、复分解反应 B、分解反应 C、置换反应 D、化合反应18. 在托盘天平的两个托盘上各放一只烧杯,分别注入相同质量分数、相同质量的稀盐酸,天平平衡.向左边的烧杯中加入10g金属锌,向右边的烧杯中加入10g金属镁.当反应停止后,金属都有剩余,天平指针的指向是( ) A、分度盘的左边 B、分度盘的中间 C、分度盘的右边 D、3种情况都有可能19. 甲、乙两物质的溶解度曲线如右图所示,下列说法正确的是( )
A、分度盘的左边 B、分度盘的中间 C、分度盘的右边 D、3种情况都有可能19. 甲、乙两物质的溶解度曲线如右图所示,下列说法正确的是( ) A、甲物质的溶解度大于乙物质的溶解度 B、t1℃时,甲、乙两物质的溶解度相等,均为30g C、t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数 D、甲的溶解度受温度影响较小
A、甲物质的溶解度大于乙物质的溶解度 B、t1℃时,甲、乙两物质的溶解度相等,均为30g C、t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数 D、甲的溶解度受温度影响较小二、填空题
-
20. 用元素符号或化学式表示:(1)、澄清石灰水的主要成分是;(2)、两个铝离子;(3)、三个双氧水分子;(4)、碳酸亚铁中铁元素的化合价 .21. 在高温条件下,A、B两种物质可以发生化学反应生成C和D.反应前后分子种类变化的微观示意图如下所示.
 (1)、一个A分子中共含有个原子,B代表的是(填化学式).(2)、四种物质中,属于单质的是(填图中的字母,下同),可用作燃料的是 .(3)、在该反应中,以下叙述正确的是 .
(1)、一个A分子中共含有个原子,B代表的是(填化学式).(2)、四种物质中,属于单质的是(填图中的字母,下同),可用作燃料的是 .(3)、在该反应中,以下叙述正确的是 .a.属于置换反应 b.原子种类没有改变
c.分子的个数没有改变 d.A物质中某元素的质量分数为25%
(4)、在该反应中,生成C和D的质量比为 .22. 学好化学可以帮助我们分析和解决生产、生活中的问题.(1)、为了全民的健康,我国推广使用强化铁酱油,这里的“铁”指的是(填“单质”、“元素”或“原子”).(2)、铁容易在潮湿的环境中生锈,实际上是铁与空气中的水分和共同作用的结果.23. 在生产生活中,你会发现“化学就在身边”.(1)、洗洁精能清除油污,这是利用它的作用.(2)、上海世博园内安装的“直饮水”机,采用“活性炭+超滤层+紫外线”净水工艺.活性炭在此起作用,净化后的水属于(选填“混合物”或“纯净物”).(3)、在农业生产中,施用的草木灰(有效成分为K2CO3)属于肥.(4)、在含有硫酸镁、硫酸铜的工业废水中加入过量的锌粉,充分反应后过滤,所得固体是(填写化学式) .(5)、化学为体育不仅雪中送炭,而且锦上添花.举重、体操等项目的运动员在比赛前常用白色的“镁粉”搓手,这是因为“镁粉”质轻、吸水性好,可做防滑剂.“镁粉”的有效成分是碱式碳酸镁,它不可燃,300℃即分解,其分解的化学方程式是:Mg5(OH)2(CO3)4 5MgO+X+4CO2↑,则X的化学式是;根据这些信息,还能推断出“镁粉”的另一种用途是 .
24. A、B两种固体物质的溶解度曲线如图所示.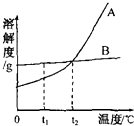
①t1℃时,A和B的溶解度大小关系是
②把t1℃时A的饱和溶液变成不饱和溶液,除了升高温度外,还可以采取的方法有 .
③t2℃时A的溶解度为25g,在t2℃时,向50g水中加入20g的A物质,充分溶解所得溶液的溶质质量分数为 .
④A中混有少量的杂质B,若想得到较为纯净的A,可以采用的方法是 .
25. A为含三种元素的钠盐,C为相对分子质量为100白色不溶物,请填空: (1)、A、B、C . (填写化学式)(2)、D中一定含有的溶质是 . 理由是(用化学方程式表示) .(3)、D还可能含有溶质是 .
(1)、A、B、C . (填写化学式)(2)、D中一定含有的溶质是 . 理由是(用化学方程式表示) .(3)、D还可能含有溶质是 .三、实验题
-
26. 实验室制取气体所需的装置如图所示.

请回答以下问题.
(1)、写出标号仪器的名称:a .(2)、用过氧化氢溶液和二氧化锰制取氧气的化学方程式为 . 用高锰酸钾制取氧气时,所选用的发生装置为(填字母).(3)、用大理石和稀盐酸制取二氧化碳的化学方程式为 . 用装置(填字母)收集一瓶二氧化碳,将燃着的木条接近瓶口,若观察到 , 说明瓶中已充满二氧化碳.(4)、炼铁的原理是利用一氧化碳与氧化铁反应.在实验室里,可用下图所示装置进行实验,该实验还可得出有关一氧化碳的相关化学性质是(用化学方程式表示) . 27. 漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,即可用作漂白剂,又可用作消毒剂.漂白粉中有效成分是[Ca(ClO)2],漂白的原理是:Ca(ClO)2在空气中发生反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色.(1)、漂白粉是一种(填“纯净物”或“混合物”).(2)、HClO在常温下分解,反应为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH(填“增大”或“减小”或“不变”).(3)、在漂白粉中滴加盐酸,能加快漂白的速率.写出漂白粉中加入盐酸反应的化学方程式 .(4)、有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验.
27. 漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,即可用作漂白剂,又可用作消毒剂.漂白粉中有效成分是[Ca(ClO)2],漂白的原理是:Ca(ClO)2在空气中发生反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色.(1)、漂白粉是一种(填“纯净物”或“混合物”).(2)、HClO在常温下分解,反应为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH(填“增大”或“减小”或“不变”).(3)、在漂白粉中滴加盐酸,能加快漂白的速率.写出漂白粉中加入盐酸反应的化学方程式 .(4)、有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验.【提出问题】长时间放置的漂白粉是否变质?
【猜 想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3 .
【实验探究】限选试剂及仪器:盐酸、石灰水、品红溶液、试管、带导管的单孔塞.
实验操作
实验现象
实验结论
1①取少量样品于试管中, .
有气体产生,气体使石灰水变浑浊.
猜想2成立
②在上述反应后的试管中加少量品红溶液.
.
四、计算题
-
28. 称取NaCl和BaCl2的固体混合物32.5g,加入100g蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的Na2SO4溶液,反应生成BaSO4沉淀的质量与所加入的Na2SO4溶液的质量关系如图所示.试回答下列问题:(提示:BaCl2+Na2SO4═BaSO4+↓+2NaCl)
 (1)、完全反应后生成BaSO4沉淀 g.(2)、恰好完全反应时消耗Na2SO4溶液的质量是 g.(3)、恰好完全反应时所得溶液中溶质的质量分数是多少?(精确到0.1%)
(1)、完全反应后生成BaSO4沉淀 g.(2)、恰好完全反应时消耗Na2SO4溶液的质量是 g.(3)、恰好完全反应时所得溶液中溶质的质量分数是多少?(精确到0.1%)