2017_2018学年高中化学新人教版必修二 第四章 第一节 开发利用金属矿物和海水资源
试卷更新日期:2018-04-27 类型:同步测试
一、单选题
-
1. 下列有关海水综合利用的说法正确的是( )A、电解熔融的氯化镁可制备镁单质和氯气 B、从海水制食盐主要是通过化学变化完成 C、电解氯化铝可以制得铝单质和氯气 D、从海水中提取钠单质只发生物理变化2. 下列冶炼金属的方法正确的是( )A、电解MgO制取Mg B、加热条件下用CO还原Ag2O制取Ag C、在Al和F2O3反应中,生成11.2gFe,转移电子数为0.6NA D、电解NaCl溶液制取Na3. 属于铝热反应的是( )A、Al+HCl B、Al+H2SO4 C、Al+MgO D、Al+MnO24. 下列说法不正确的是( )A、形成酸雨的主要物质是硫的氧化物和氮的氧化物 B、海洋元素﹣﹣溴的提取常用“空气吹出法”,该制备方法中溴元素依次经过被氧化、被还原、被氧化的三过程 C、绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 D、水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的5. 我国钨资源矿产丰富.由黑钨矿提取钨发生的反应之一为:3H2+WO3 W+3H2O.其基本反应类型是( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应6. 下列反应原理不符合工业冶炼金属实际情况的是( )A、2HgO 2Hg+O2↑ B、Fe2O3+3CO 2Fe+3CO2 C、2MgO 2Mg+O2↑ D、2Al2O3 4Al+3O2↑7. 下列说法正确的是( )A、目前,工业上冶炼铝通常采用的方法是铝热反应法 B、铝能用于冶炼难熔的金属(如Cr、V、Mn等),这是因为铝具有还原性,在冶炼反应中放出大量的热量 C、由海水制备无水氯化镁,主要有以下步骤:①加熟石灰;②过滤;③加盐酸;④蒸发结晶;⑤在一定条件下脱水干燥 D、在冶金工业上,Na、Mg、Al、K、Ca、Zn 均不能用常用化学还原剂制得8. 下列金属中,通常采用电解法冶炼的是( )A、Fe B、Cu C、Al D、Hg9. 铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝.下列说法不正确的是( )
 A、①、②、③中除加试剂外,还需要进行过滤操作 B、a、b中铝元素的化合价相同 C、③中需要通入过量的氨气 D、④进行的操作是加热,而且d一定是氧化铝10. 海洋中有丰富的食品、矿产、能源、药物和水产资源,对今后世界经济发展有着决定性作用.下列有关说法正确的是( )
A、①、②、③中除加试剂外,还需要进行过滤操作 B、a、b中铝元素的化合价相同 C、③中需要通入过量的氨气 D、④进行的操作是加热,而且d一定是氧化铝10. 海洋中有丰富的食品、矿产、能源、药物和水产资源,对今后世界经济发展有着决定性作用.下列有关说法正确的是( ) A、工段②是风化过程 B、在工段③④⑤中溴元素均被氧化 C、工业上电解熔融状态下的氯化镁制取镁单质 D、工段①中除去粗盐中的SO42﹣、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
A、工段②是风化过程 B、在工段③④⑤中溴元素均被氧化 C、工业上电解熔融状态下的氯化镁制取镁单质 D、工段①中除去粗盐中的SO42﹣、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸二、填空题
-
11. 我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L﹣1 . 其工业提取法有:
Ⅰ.空气吹出纯碱吸收法.方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴.该方法涉及的反应有:
①Cl2+2Br﹣═Br2+2Cl﹣
②3Br2+3CO ═BrO +5Br﹣+3CO2↑;
③BrO +5Br﹣+6H+═3Br2+3H2O
其中②中的氧化剂是 , ③中的还原剂是 .
Ⅱ.空气吹出SO2吸收法.该方法基本同(Ⅰ),只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴.
写出溴与二氧化硫反应的化学方程式 .
Ⅲ.溶剂萃取法.该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的.
实验室中萃取用到的主要实验仪器名称是 .
下列可以用于海水中溴的萃取的试剂是(填序号).
①乙醇②四氯化碳③硝酸.
12. 在人们生产、生活等各种活动中都离不开化学物质,比如:金属是人类生活中用途广泛的金属材料,即使有毒的苯也是重要的化工原料,请回答下面与金属和苯有关的问题:Ⅰ.写出下列反应的化学方程式.
(1)用铝加热反应炼铁: ;
(2)由苯制取硝基苯: ;
Ⅱ.现有X、Y、Z、W四种金属片,①把X、Y用导线连接后同时浸入稀硫酸溶液中,X上有气泡产生;②把Z、W用导线连接后同时浸入稀硫酸溶液中,溶液中H+移向W;③把X、Z用导线连接后同时浸入稀硫酸溶液中,电子流动方向为X→导线→Z.
(1)在①中,金属片发生氧化反应 ;
(2)在②中,金属片 作负极;
(3)如果把Y、W用导线连接后同时浸入稀硫酸溶液,则金属片 上有气泡产生;
(4)上述四种金属的活动顺序是 .
三、综合题
-
13. 海水中含有丰富的Na+、Mg2+、Cl﹣、Br﹣等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.(1)、如图是采用膜分离技术的海水淡化示意图.淡化膜可以让水分子通过,而海水中其他分子和离子均不能通过.加压后,左侧淡水中增加的是(填字母).
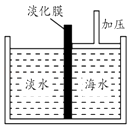
a.溶质质量 b.溶剂质量 c.溶质的质量分数
(2)、从海水中提取镁的主要步骤如下: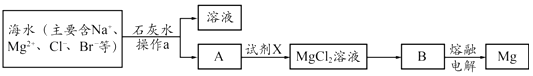
①操作a的名称是 .
②写出B冶炼金属镁的化学方程式 .
(3)、空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是以预先经过酸化的浓缩海水为原料,通过以下步骤提取溴:步骤一:用氯气置换溴离子使之成为单质溴;
步骤二:通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用转化成氢溴酸;
步骤三:用氯气将氢溴酸氧化得到产品溴.
①步骤一和步骤二的目的是 .
②步骤二中发生反应的化学方程式为 .